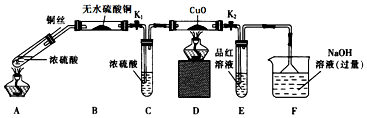
题目内容
5.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):H2(g)+Cl2(g)→2HCl(g)+Q1KJ H2(g)+Br2(g)→2HBr(g)+Q2KJ 根据上述反应做出的判断不正确的是( )| A. | Q1>Q2 | |
| B. | 生成物总能量均低于反应物总能量 | |
| C. | 生成 2mol HCl(g)放出 Q1KJ 热量 | |
| D. | 若反应生成 2mol 液态溴化氢,放出的热量低于 Q2KJ |
分析 非金属性Cl>Br,则氯气比溴活泼,能量高,与氢气反应均为放热反应,且物质的量与热量成正比,以此来解答.
解答 解:A.因为Cl2比Br2活泼,Cl-Cl键能较大,放出的热量更多,为Q1>Q2,故A正确;
B.两个反应都是放热反应,生成物的总能量低于反应物的总能量,故B正确;
C.由热化学方程式可知,生成2mol氯化氢放出的热量是Q1,故C正确;
D.气态比液态能量高,则若反应生成 2mol 液态溴化氢,放出的热量高于 Q2KJ,故D错误.
故选D.
点评 本题考查反应热与焓变,为高频考点,把握活泼性与反应中能量变化为解答的关键,侧重分析与应用能力的考查,注意选项A为解答的难点,题目难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
13.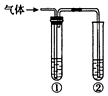 用下图装置完成下列实验,不需要试管①(内盛有相应的除杂试剂)就能达到实验目的是( )
用下图装置完成下列实验,不需要试管①(内盛有相应的除杂试剂)就能达到实验目的是( )
 用下图装置完成下列实验,不需要试管①(内盛有相应的除杂试剂)就能达到实验目的是( )
用下图装置完成下列实验,不需要试管①(内盛有相应的除杂试剂)就能达到实验目的是( ) | 实验目的 | ②中的试剂 | |
| A | 检验碳与浓硫酸反应产生的气体中含有二氧化碳 | 澄清石灰水 |
| B | 用碳酸钙与盐酸反应产生的气体验证碳酸的酸性强于苯酚 | 苯酚钠溶液 |
| C | 验证乙醇在浓硫酸作用下发生消去反应产生的气体为不饱和烃 | 酸性高锰酸钾溶液 |
| D | 验证石蜡油在碎瓷片上受热分解产生的气体中含有不饱和烃 | 溴的四氯化碳溶液 |
| A. | A | B. | B | C. | C | D. | D |
20.室温下,H2+Cl2$\stackrel{点燃}{→}$2HCl 生成 0.1mol HCl,下列说法正确的是( )
| A. | 生成 0.1 NA 根共价键 | B. | 消耗反应物总体积 2.24L | ||
| C. | 转移了 2 NA 个电子 | D. | 产物溶于水后,溶液 pH=1 |
10.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 L SO3与水反应生成1 mol硫酸 | |
| B. | 1 L 1mol/L醋酸溶液中离子总数为2 NA | |
| C. | 78 g苯中含有的碳碳双键的数目为3 NA | |
| D. | 1 mol N2与3 mol H2在一定条件下充分反应生成的NH3分子数小于2 NA |
17.下列有关实验能成功的是( )
| A. | 苯加到溴水中,将会和溴发生取代反应而使溴水褪色 | |
| B. | 用冷却结晶法来提纯含少量KCl杂质的KNO3晶体 | |
| C. | 将10%的葡萄糖溶液加到新制氢氧化铜悬浊液中,出现砖红色沉淀 | |
| D. | 进行淀粉水解实验时,为检验水解产物和水解程度,加液顺序为淀粉溶液→H2SO4溶液→NaOH溶液→碘水→新制Cu(OH)2悬浊液 |
14.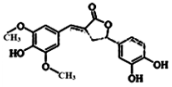 天然有机化合物甲的结构简式如图,该物质具有一定的除草功效,有关该化合物的说法正确的是( )
天然有机化合物甲的结构简式如图,该物质具有一定的除草功效,有关该化合物的说法正确的是( )
 天然有机化合物甲的结构简式如图,该物质具有一定的除草功效,有关该化合物的说法正确的是( )
天然有机化合物甲的结构简式如图,该物质具有一定的除草功效,有关该化合物的说法正确的是( )| A. | 既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2 | |
| B. | 1 mol该化合物最多能与6 mol NaOH 反应 | |
| C. | 1 mol 该化合物最多能与含5 mol Br2的浓溴水反应 | |
| D. | 该化合物分子中含有三种含氧官能团 |
15.将浓度均为0.2mol/L的CH3COOH和CH3COONa溶液等体积混合,混合液呈弱酸性,其中有三种微粒的浓度非常接近,这三种微粒是( )
| A. | CH3COO- Na+ CH3COOH | B. | CH3COO- CH3COOH H+ | ||
| C. | CH3COOH OH- H+ | D. | CH3COO- OH- H+ |
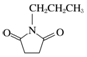 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: