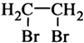题目内容
某溶液由NaCl、MgCl2、Al2(SO4)3、Na2SO4组成,已知c(Na+)=0.4mol/L,c(Al3+)=0.2mol/L,c(Mg2+)=0.1mol/L,c(Cl-)=0.3mol/L,则SO42-物质的量浓度为( )
| A、0.3mol/L |
| B、0.4mol/L |
| C、0.45mol/L |
| D、0.55mol/L |
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:根据溶液不显电性,则阳离子的电荷总数等于阴离子的电荷总数,以此来计算.
解答:
解:c(Na+)=0.4mol/L,c(Al3+)=0.2mol/L,c(Mg2+)=0.1mol/L,c(Cl-)=0.3mol/L,设SO42-的物质的量浓度为x,
由电荷守恒可知,
0.4mol/L×1+0.2mol/L×3+0.1mol/L×2=0.3mol/L×1+x×2,
解得x=0.45mol/L,
故选C.
由电荷守恒可知,
0.4mol/L×1+0.2mol/L×3+0.1mol/L×2=0.3mol/L×1+x×2,
解得x=0.45mol/L,
故选C.
点评:本题考查物质的量浓度的有关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,明确溶液不显电性是解答本题的关键,难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
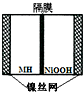 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池 (MH-Ni碱性电池).下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池 (MH-Ni碱性电池).下列有关说法不正确的是( )| A、放电时正极反应为:NiOOH+H2O+e-=Ni(OH)2+OH- |
| B、放电时负极反应为:MH+OH--2e-=H2O+M+ |
| C、充电时氢氧根离子移向阳极,要参与电极反应 |
| D、充电时电池的正极连接直流电源的正极,得到电子发生还原反应 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、28g氮气所含有的原子数目为NA |
| B、化学反应中1mol金属镁变成镁离子时失去电子数目为2NA |
| C、标准状况下,22.4L水中含有个水分子NA |
| D、标准状况下,22.4L氯化氢所含的原子数为NA |
设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A、4.6g 由NO2和N2O4组成的混合物中含有氧原子的数目为 0.2NA |
| B、1 mol Na2O2固体中含离子总数为4NA |
| C、标准状况下,1.12LCCl4含有C-Cl键的数目为0.2NA |
| D、将0.1mol FeCl3溶于 1L水中,所得溶液中含有0.1NA个Fe3+ |
等质量的下列气体所含原子数最多的是( )
| A、C2H6 |
| B、CH4 |
| C、CO |
| D、H2 |
某课外实验小组设计的下列实验合理的是( )
A、 制备并观察氢氧化亚铁 |
B、 除去二氧化碳中的氯化氢 |
C、 制取干燥、纯净氯气 |
D、 制取少量氧气 |
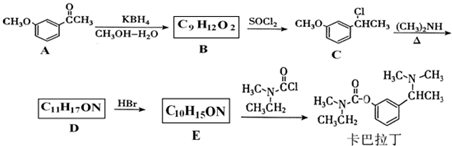
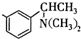 基团 ②属于α-氨基酸 ③含有三个手性碳原子.
基团 ②属于α-氨基酸 ③含有三个手性碳原子.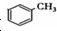 )和丙酮(
)和丙酮(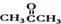 ) 制备化合物
) 制备化合物 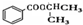 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH