题目内容
某课外实验小组设计的下列实验合理的是( )
A、 制备并观察氢氧化亚铁 |
B、 除去二氧化碳中的氯化氢 |
C、 制取干燥、纯净氯气 |
D、 制取少量氧气 |
考点:化学实验方案的评价
专题:
分析:A.Fe(OH)2不稳定,易被氧气氧化生成Fe(OH)3;
B.碳酸钠能与二氧化碳反应;
C.应先通过饱和食盐水;
D.过氧化钠为粉末固体,隔板不能使固体与液体分离.
B.碳酸钠能与二氧化碳反应;
C.应先通过饱和食盐水;
D.过氧化钠为粉末固体,隔板不能使固体与液体分离.
解答:
解:A.Fe(OH)2不稳定,易被氧气氧化生成Fe(OH)3,为防止氢氧化亚铁被氧化,应该隔绝空气,故A正确;
B.碳酸钠能与二氧化碳反应,将原物质除去,故B错误;
C.应先通过饱和食盐水再用浓硫酸干燥,故C错误;
D.过氧化钠为粉末固体,隔板不能使固体与液体分离,则图中装置不能用于制备少量氧气,故D错误.
故选A.
B.碳酸钠能与二氧化碳反应,将原物质除去,故B错误;
C.应先通过饱和食盐水再用浓硫酸干燥,故C错误;
D.过氧化钠为粉末固体,隔板不能使固体与液体分离,则图中装置不能用于制备少量氧气,故D错误.
故选A.
点评:本题考查了实验方案评价,涉及物质的制取、分离提纯等知识点,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
某溶液由NaCl、MgCl2、Al2(SO4)3、Na2SO4组成,已知c(Na+)=0.4mol/L,c(Al3+)=0.2mol/L,c(Mg2+)=0.1mol/L,c(Cl-)=0.3mol/L,则SO42-物质的量浓度为( )
| A、0.3mol/L |
| B、0.4mol/L |
| C、0.45mol/L |
| D、0.55mol/L |
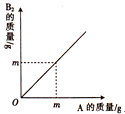 已知反应aA+B2=aAB,M(A)、M(B2)、M(AB)分别表示A、B2和AB的摩尔质量,其单位均为g/mol.A与B2反应的质量关系如图所示.下列说法中正确的是( )
已知反应aA+B2=aAB,M(A)、M(B2)、M(AB)分别表示A、B2和AB的摩尔质量,其单位均为g/mol.A与B2反应的质量关系如图所示.下列说法中正确的是( )| A、无法确定计量数a的大小 |
| B、M(A)=2M(B2) |
| C、M(AB)=2M(A)+M(B2) |
| D、若有6g A完全反应,则生成AB的质量为12g |
阿魏酸在食品、医药等方面有广泛用途.一种合成阿魏酸的反应可表示为下列说法正确的是( )
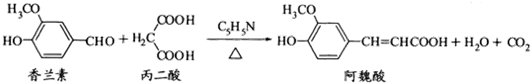

| A、香兰素、阿魏酸均可与溴水反应,且反应类型完全相同 |
| B、香兰素、阿魏酸均可与NaHCO3、NaOH溶液反应 |
| C、与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种 |
| D、通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应 |
常温下,某溶液中由水电离出的出c(H+)=1.0×10-13mol/L则在该溶液中一定不可以大量共存的一组离子是( )
| A、NH4+、NO3-、K+、SO42- |
| B、CO32_、NO3-、HCO3-、Na+ |
| C、Na+、ClO-、AlO2-、NO3- |
| D、MnO4-、K+、Na+、SO42- |

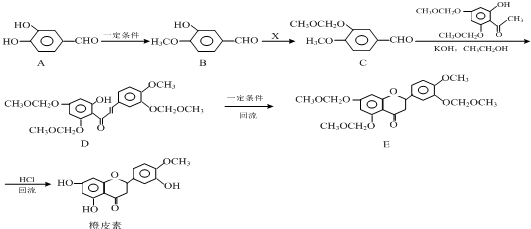
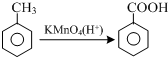 结合流程信息,写出以对甲基苯酚和上述流程中的“X”为原料,制备
结合流程信息,写出以对甲基苯酚和上述流程中的“X”为原料,制备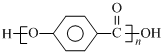 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
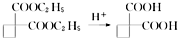 ,请你设计出合理的反应流程图.
,请你设计出合理的反应流程图.