题目内容
有aXm+和bYn-两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是( )
| A、b-a=n+m |
| B、a-b=n+m |
| C、核电荷数Y=X |
| D、核电荷数Y>X |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:根据两种离子的电子层结构相同,则核外电子数相同,根据构成离子的原子序数、电荷数、质子数之间的关系判断.
解答:
解:由aXm+和bYn-的电子层结构相同知,这两种离子的核外电子数相等,核外电子数=核内质子数-阳离子的电荷数=核内质子数+阴离子的电荷数,所以得:a-m=b+n,即a-b=n+m;
原子序数=核内质子数=核电荷数,则X>Y,
故选B.
原子序数=核内质子数=核电荷数,则X>Y,
故选B.
点评:本题考查微粒的结构,学生应明确阳离子和阴离子的核外电子的计算,充分利用离子的电子层结构相同来列等式解答.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
第三周期元素基态原子中未成对电子数最多可达( )
| A、2个 | B、3个 | C、4个 | D、5个 |
A、B、C、D为四种短周期主族元素,且原子序数依次增大.已知A的最外层电子数 是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子.下列说法正确的是( )
| A、原子半径:A<B<C<D |
| B、B元素在周期表中的位置为第二周期第 VIA族 |
| C、D元素最高价氧化物的水化物难溶于水 |
| D、C、D、A、B四种元素的最高化合价依次升高 |
有36g1H35Cl和80g3H37Cl,下列说法正确的是( )
| A、两者所含中子数之比为1:2 |
| B、分别与足量Na反应时,两者生成气体的质量之比为1:6 |
| C、与NaOH溶液发生中和反应所消耗的NaOH的物质的量之比为1:1 |
| D、两者所含质子数之比为9:22 |
在一定温度下,将一定质量的混合气体在密闭容器中发生反应aA(g)+bB(g)?cC(g)+dD(g),达到平衡时测得B气体的浓度为0.6mol/L,恒温下将密闭容器的容积扩大1倍,重新达到平衡时,测得B气体的浓度为0.4mol/L,下列叙述中正确的是( )
| A、a+b>c+d |
| B、平衡向右移动 |
| C、重新达平衡时,A气体浓度增大 |
| D、重新达平衡时,D的体积分数减小 |
下列叙述中正确的是( )
| A、干燥的NaCl晶体不能导电,所以它不是电解质 |
| B、食盐水能导电,所以食盐水是电解质 |
| C、食盐水通电时可电离出Na+和Cl- |
| D、食盐水溶液呈电中性 |
已知反应A2(g)+2B2(g)?2AB2(g)△H>0,下列说法正确的是( )
| A、升高温度正反应速率加快,逆反应速率减慢 |
| B、0.1mol A2和0.2mol B2反应达到平衡时生成0.2mol AB2 |
| C、达平衡后,升高温度,B的转化率增大 |
| D、催化剂可同等程度地改变正、逆反应速率 |
2NO(g)+O2(g)2NO2(g)△H=-112kJ/mol.在一密闭容器中充入1.0mol NO和足量氧气,充分反应后放出的热量为( )
| A、112kJ |
| B、56kJ |
| C、小于56kJ |
| D、-56kJ |
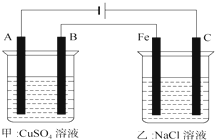 如图为相互串联的甲、乙两个电解池(电极A、B、C都是惰性电极),请回答:
如图为相互串联的甲、乙两个电解池(电极A、B、C都是惰性电极),请回答: