题目内容
18.燃料广泛应用于工农业生产和人民生活,随着科技的发展,人类正在更加合理地开发和利用燃料,并尽量追求环保理念.下列关于燃料的说法正确的是( )| A. | 氢气是具有热值高、无污染等优点的燃料 | |
| B. | “可燃冰”是将水变为油的新型燃料 | |
| C. | 乙醇是比汽油更环保、不可再生的燃料 | |
| D. | 石油和煤是工厂经常使用的可再生的化石燃料 |
分析 A、氢气的燃烧产物是水;
B、可燃冰”外观像冰,其化学组成是CH4•nH2O;
C、乙醇是可再生能源;
D、煤和石油都是不可再生能源.
解答 解:A.氢能源具有来源广、热值高,且燃烧后生成水对环境无污染,故A正确;
B.可燃冰”外观像冰,其化学组成是CH4•nH2O,水的化学式为H2O,根据元素守恒知,水不能变为油,故B错误;
C.乙醇中含有碳、氢、氧三种元素,其燃烧产物是二氧化碳和水,但乙醇为可再生能源,故C错误;
D.石油和煤都属于化石燃料,且属于不可再生能源,故D错误;
故选A.
点评 本题考查了燃料的有关知识,知道再生能源与不再生能源的判断方法,难度不大.

练习册系列答案
相关题目
8.某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
实验记录如下:
请回答下列问题:
(1)A中反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
(2)实验操作Ⅱ吹入热空气的目的是吹出单质溴.
(3)装置C的作用是吸收尾气,C中盛放的药品是NaOH溶液.
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(5)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
实验记录如下:
| 实验操作 | 现象及结论 | |
| Ⅰ | 打开活塞a,滴加氯水,关闭活塞 | A中溶液变为红棕色 |
| Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
| Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |

(1)A中反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
(2)实验操作Ⅱ吹入热空气的目的是吹出单质溴.
(3)装置C的作用是吸收尾气,C中盛放的药品是NaOH溶液.
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(5)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
9.下列粒子半径大小比较,正确的是( )
| A. | Na+<Mg2+<Al3+<K+ | B. | S2->Cl->K+>Ca2+ | ||
| C. | Cl>S>F>O | D. | S2->O2->Cl->Br- |
6.氢气还原氧化铜的反应为:CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,在该反应中( )
| A. | CuO作还原剂 | B. | CuO作氧化剂 | ||
| C. | 铜元素化合价降低 | D. | 氢元素化合价升高 |
13.能正确表示下列反应的离子方程式是( )
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O | |
| C. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
7.(Ⅰ)氨基甲酸铵(NH2COONH4)的制备氨基甲酸铵是一种白色固体,易分解、易水解,难溶于CCl4.可用做肥料.
制备氨基甲酸铵的装置如图1所示.反应的化学方程式如下:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0.
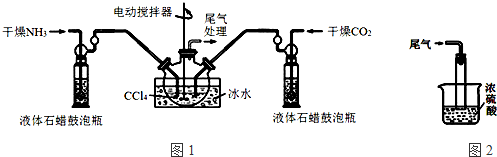
注:四氯化碳与液体石蜡均为惰性介质.
(1)发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).
(2)液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例.
(3)从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是C(填写选项序号).
a.80℃热风下烘干 b.60℃热风下烘干 c.40℃热风下烘干
(4)尾气处理装置如图2所示.双通玻璃管的作用:防止倒吸;浓硫酸的作用:吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解.
(5)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.则样品中氨基甲酸铵的物质的量分数为80%.(精确到2位小数,碳酸氢铵和氨基甲酸铵的相对分子质量分别为79和78)
(Ⅱ) FeSO4•7H2O晶体的制备
(6)已知:
某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,制备绿矾(FeSO4•7H2O),补充完整由硫铁矿烧渣制备FeSO4•7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):
①向一定量烧渣中加入足量的稀硫酸充分反应,充分反应后过滤,
②向滤液中加入足量的铁粉,
③过滤,滤液中滴加NaOH溶液调节反应液的pH约为5,过滤,
④将得到溶液加热蒸发浓缩,冷却结晶,过滤,洗涤,低温干燥,得到FeSO4•7H2O晶体.
制备氨基甲酸铵的装置如图1所示.反应的化学方程式如下:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0.

注:四氯化碳与液体石蜡均为惰性介质.
(1)发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).
(2)液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例.
(3)从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是C(填写选项序号).
a.80℃热风下烘干 b.60℃热风下烘干 c.40℃热风下烘干
(4)尾气处理装置如图2所示.双通玻璃管的作用:防止倒吸;浓硫酸的作用:吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解.
(5)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.则样品中氨基甲酸铵的物质的量分数为80%.(精确到2位小数,碳酸氢铵和氨基甲酸铵的相对分子质量分别为79和78)
(Ⅱ) FeSO4•7H2O晶体的制备
(6)已知:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
①向一定量烧渣中加入足量的稀硫酸充分反应,充分反应后过滤,
②向滤液中加入足量的铁粉,
③过滤,滤液中滴加NaOH溶液调节反应液的pH约为5,过滤,
④将得到溶液加热蒸发浓缩,冷却结晶,过滤,洗涤,低温干燥,得到FeSO4•7H2O晶体.
8.异胡薄荷醉(结构如图所示)是合成青蒿素的原料之一,下列说法正确的是( )
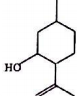

| A. | 其分子式为C10H18O | B. | 含有1个手性碳原子 | ||
| C. | 能发生消去反应 | D. | 可与FeCl3溶液反应显示紫色 |