题目内容
9.下列粒子半径大小比较,正确的是( )| A. | Na+<Mg2+<Al3+<K+ | B. | S2->Cl->K+>Ca2+ | ||
| C. | Cl>S>F>O | D. | S2->O2->Cl->Br- |
分析 核外电子排布相同,核电荷数越大离子半径越小;最外层电子数相同,电子层越多半径越大;电子层数相同,核电荷数越大半径越小,以此来解答.
解答 解:A.Na+、Mg2+、Al3+微粒都是两个电子层,核电荷数越多,半径越小,所以粒子半径Al3+<Mg2+<Na+,故A错误;
B.S2-、Cl-、K+、Ca2+具有相同的核外电子排布,核电荷数越大离子半径越小,则S2->Cl->K+>Ca2+,故B正确;
C.电子层一样,核电荷数越多,半径越小,所以S>Cl;O>F,故C错误;
D.离子电子层数越多,离子半径越大,O2-半径应最小,故D错误.
故选B.
点评 本题考查微粒半径大小比较,为高频考点,侧重于元素周期律的综合考查与运用,难度中等,关键清楚微粒半径大小比较的规律.

练习册系列答案
相关题目
17.下列关于pH值的叙述正确的是( )
| A. | 常温下,4体积pH=9的Ca(OH)2溶液与1体积pH=13的NaOH溶液混合后,氢离子浓度是1×10-13mol/L | |
| B. | 用盐酸滴定氨水时,能用酚酞做指示剂(酚酞的变色范围是pH=8~10) | |
| C. | 加热Na2CO3溶液、NaHCO3溶液和CO2与H2O饱和溶液,它们的pH值都会上升 | |
| D. | pH相同的氨水、氢氧化钠用蒸馏水稀释到原来的x倍、y倍至pH仍相同,则x<y |
14.下列关于反应中能量变化说法正确的是( )
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O (g)△H=-890.3 kJ•mol-1 | |
| B. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| C. | 常温下,反应C(s)+CO2(g)═2CO(g) 不能自发进行,则该反应的△H<0 | |
| D. | 已知①2H2(g)+O2(g)═2H2O (g)△H1=a kJ•mol-1②2H2(g)+O2(g)═2H2O (l)△H2=b kJ•mol-1,则a>b |
1.有人用全钒液流电池:VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,在空气中电解水(酸性条件下)的方法,阳极制得臭氧,阴极制得过氧化氢,电解总方程式为3H2O+3O2═3H2O2+O3,其中H2O2只为还原产物.下列说法正确的是( )
| A. | 原电池放电时正极反应为VO2++2H++e-═VO2++H2O | |
| B. | 充电时阴极反应为V2+-e-═V3+ | |
| C. | 电解池的阴极反应式为3O2+6H2O+6e-═3H2O2+6OH- | |
| D. | 电解池中生成22.4 L O3(标准状况)时,转移3 mol电子 |
18.燃料广泛应用于工农业生产和人民生活,随着科技的发展,人类正在更加合理地开发和利用燃料,并尽量追求环保理念.下列关于燃料的说法正确的是( )
| A. | 氢气是具有热值高、无污染等优点的燃料 | |
| B. | “可燃冰”是将水变为油的新型燃料 | |
| C. | 乙醇是比汽油更环保、不可再生的燃料 | |
| D. | 石油和煤是工厂经常使用的可再生的化石燃料 |
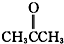 酮类 ③CH3CH2Br卤代烃
酮类 ③CH3CH2Br卤代烃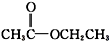 酯类 ⑤
酯类 ⑤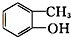 酚类 ⑥
酚类 ⑥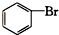 卤代烃
卤代烃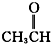 醛类 ⑧
醛类 ⑧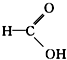 羧酸类 ⑨
羧酸类 ⑨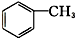 芳香烃.
芳香烃.