题目内容
工业“从海水中提取镁”的流程图如下:
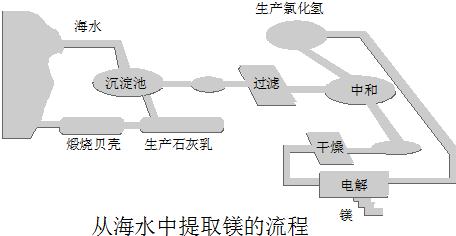
其步骤为:
①将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
②将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
③在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2?6H2O;
④将MgCl2?6H2O在一定条件下加热得到无水MgCl2;
⑤电解熔融的氯化镁可得到Mg.
请回答以下问题:
(1)步骤③中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主
要仪器有 、 、酒精灯、铁架台等.
(2)步骤④中的“一定条件”指的是 ,目的是 .
(3)上述提取镁的流程中,在降低成本、减少污染方面做了一些工作,请写出其中一点: .
(4)有同学认为:步骤②后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则.你同意该同学的想法吗?为什么?
你的观点是 ;理由是 .

其步骤为:
①将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
②将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
③在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2?6H2O;
④将MgCl2?6H2O在一定条件下加热得到无水MgCl2;
⑤电解熔融的氯化镁可得到Mg.
请回答以下问题:
(1)步骤③中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主
要仪器有
(2)步骤④中的“一定条件”指的是
(3)上述提取镁的流程中,在降低成本、减少污染方面做了一些工作,请写出其中一点:
(4)有同学认为:步骤②后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则.你同意该同学的想法吗?为什么?
你的观点是
考点:海水资源及其综合利用
专题:
分析:(1)在蒸发结晶过程中,使用的主要仪器有带铁圈的铁架台、酒精灯、玻璃棒和蒸发皿等;
(2)考虑镁离子的水解,一定条件是防止水解的发生;
(3)降低成本、减少污染方面是利用生成的氯气生产氯化氢,减少污染;利用贝壳分解生成氧化钙制备氢氧化钙,降低成本;
(4)MgO熔点远高于MgCl2,应注意节约能源.
(2)考虑镁离子的水解,一定条件是防止水解的发生;
(3)降低成本、减少污染方面是利用生成的氯气生产氯化氢,减少污染;利用贝壳分解生成氧化钙制备氢氧化钙,降低成本;
(4)MgO熔点远高于MgCl2,应注意节约能源.
解答:
解:(1)在蒸发结晶过程中,使用的主要仪器有带铁圈的铁架台、酒精灯、玻璃棒和蒸发皿等,故答案为:蒸发皿;玻璃棒;
(2)MgCl2?6H2O在一定条件下加热得到无水MgCl2,若直接加热MgCl2?6H2O,会促进Mg2+水解,得不到无水MgCl2,因Mg2+水解呈酸性,在氯化氢气流中可抑制Mg2+水解,同时带走水蒸气,故一定条件为在HCl气流中,目的是抑制Mg2+水解;
故答案为:在HCl气流中;抑制MgCl2水解生成Mg(OH)2,带走水蒸气;
(3)提取镁的流程中,降低成本、减少污染方面是利用生成的氯气生产氯化氢,减少污染;利用贝壳分解生成氧化钙制备氢氧化钙,降低成本,
故答案为:利用电解产生的氯气制备氯化氢或利用贝壳分解生成氧化钙制备石灰乳降低成本;
(4)MgO熔点远高于MgCl2,应注意节约能源,可用氯化镁代替,
故答案为:不同意;因为MgO熔点很高,熔融时耗费大量的能量增加生产成本.
(2)MgCl2?6H2O在一定条件下加热得到无水MgCl2,若直接加热MgCl2?6H2O,会促进Mg2+水解,得不到无水MgCl2,因Mg2+水解呈酸性,在氯化氢气流中可抑制Mg2+水解,同时带走水蒸气,故一定条件为在HCl气流中,目的是抑制Mg2+水解;
故答案为:在HCl气流中;抑制MgCl2水解生成Mg(OH)2,带走水蒸气;
(3)提取镁的流程中,降低成本、减少污染方面是利用生成的氯气生产氯化氢,减少污染;利用贝壳分解生成氧化钙制备氢氧化钙,降低成本,
故答案为:利用电解产生的氯气制备氯化氢或利用贝壳分解生成氧化钙制备石灰乳降低成本;
(4)MgO熔点远高于MgCl2,应注意节约能源,可用氯化镁代替,
故答案为:不同意;因为MgO熔点很高,熔融时耗费大量的能量增加生产成本.
点评:本题以从海水中提取镁为背景,考查物质的分离、提纯,盐类水解,节能减排等知识,培养了学生运用知识的能力.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、用含氢氧化铝的胃舒平治疗胃酸过多:OH-+H+=H2O |
| B、等物质的量浓度、等体积的Ca(HCO3)2溶液与氢氧化钠溶液相混合:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| C、等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3?H2O+H2O |
| D、稀硝酸与过量的铁屑反应:Fe+4H++NO3-=Fe3++NO↑+2 H2O |
装运乙醇的包装箱有一危险品标志,其下部已被损坏,其上部应是( )
A、 |
B、 |
C、 |
D、 |
为了检验某FeCl2溶液是否变质,可向溶液中加入( )
| A、NaOH | B、铁片 |
| C、KSCN溶液 | D、石蕊溶液 |
常温下,0.1mol?L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8下列叙述正确的是( )
| A、该溶液中由水电离出的c(OH-)=1×10-9mol?L-1 |
| B、浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) |
| C、0.1mol?-1LHA溶液与0.05mol?L-1NaOH溶液等体积混合所得溶液中c(A-)+c(HA)=c(Na+) |
| D、0.1mol?L-1HA溶液与0.05mol?L-1NaOH溶液等体积混合所得溶液中2c(H+)+c(HA)=c(A-)+2c(OH-) |

 在室温和大气压强下,用图示的装置进行实验,测得a g含CaC2 90%的样品与水完全反应产生的气体体积为b L.现欲在相同条件下,测定某电石试样中CaC2的质量分数,请回答下列问题:
在室温和大气压强下,用图示的装置进行实验,测得a g含CaC2 90%的样品与水完全反应产生的气体体积为b L.现欲在相同条件下,测定某电石试样中CaC2的质量分数,请回答下列问题: