题目内容
5. 某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.Ⅰ、(1)将钠、钾、镁、铝各1mol分别投入到足量的0.1mol•L-1的盐酸中,写出与盐酸反应最慢的金属发生反应的离子方程式2Al+6H+=2Al3++3H2↑.
(2)将NaOH溶液与NH4Cl溶液混合生成NH3•H2O,从而验证NaOH的碱性大于NH3•H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:不合理,用碱性强弱比较金属性强弱时,一定要用元素最高价氧化物对应水化物的碱性强弱比较,NH3•H2O不是N元素最高价氧化物对应的水化物.
Ⅱ、利用如图装置可以验证非金属性的变化规律.
(3)实验室中提供药品浓硫酸、浓盐酸、Na2S、Na2SO3、MnO2、CaCO3,若要证明非金属性Cl>S;装置A、B、C中所装药品分别为浓盐酸、KMnO4、Na2S,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为S2-+Cl2=S↓+2Cl-.
(4)若要证明非金属性:S>C>Si,则A中加H2SO4,B中加Na2CO3,C中加Na2SiO3,则观察装置C中的实验现象为有白色沉淀生成.离子方程式为SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-.
分析 I、(1)元素的金属性越强,其单质与酸或水反应越剧烈;
(2)元素的最高价氧化物的水化物的碱性越强,元素的金属性越强;
II、(3)设计实验验证非金属性:Cl>S,利用氯气与Na2S的氧化还原反应可验证;
(4)要证明非金属性:C>Si,可以通过二氧化碳和硅酸钠反应生成难溶性的硅酸来证明.
解答 解:I、(1)同一周期元素,金属性随着原子序数增大而减弱,元素的金属性越强,同一主族,原子序数越大,金属性越强,其单质与酸或水反应越剧烈,所以金属性K>Na>Mg>Al,则K与盐酸反应最剧烈、Al与盐酸反应速率最慢,离子反应为:2Al+6H+=2Al3++3H2↑,
故答案为:2Al+6H+=2Al3++3H2↑;
(2)将NaOH溶液与NH4Cl溶液混合生成NH3•H2O,可以说明NaOH的碱性大于NH3•H2O,但不能说明Na的金属性大于N,因为要验证金属性的强弱,必须通过比较最高价氧化物所对应的水化物的碱性来进行比较,而NH3•H2O不是氮元素的最高价氧化物的水化物,
故答案为:不合理,用碱性强弱比较金属性强弱时,一定要用元素最高价氧化物对应水化物的碱性强弱比较,NH3•H2O不是N元素最高价氧化物对应的水化物;
II、(3)设计实验验证非金属性:Cl>S,利用氯气与Na2S的氧化还原反应可验证,则装置A、B、C中所装药品应分别为浓盐酸、KMnO4、Na2S溶液,装置C中的实验现象为有淡黄色沉淀生成,装置C中发生反应的离子方程式为S2-+Cl2═S↓+2Cl-,
故答案为:浓盐酸、KMnO4、Na2S;S2-+Cl2═S↓+2Cl-;
(4)若要证明非金属性:C>Si,可以通过二氧化碳和硅酸钠反应生成难溶性的硅酸来证明,由于B中加Na2CO3,故A中可以加硫酸,通过硫酸和碳酸钠的反应来制取CO2,然后的CO2通入C中的Na2SiO3中,可以发生反应:Na2SiO3+2CO2+2H2O=H2SiO3↓+2NaHCO3,离子反应为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,产生白色胶状沉淀,从而可以证明酸性:H2CO3>H2SiO3,故非金属性:C>Si.
故答案为:H2SO4;Na2SiO3;SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-.
点评 本题考查了实验方案设计,涉及金属、非金属性强弱的探究,明确物质的性质是解本题关键,同时考查学生灵活运用知识解答问题的能力,题目难度中等.

| A. | 中子数为18的氯原子${\;}_{17}^{37}$Cl | B. | 硫离子的结构示意图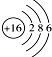 | ||
| C. | 过氧化钠的电子式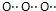 | D. | HClO的结构式H-O-Cl |
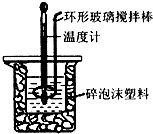 用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是减少实验过程中的热量损失;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指混合溶液的最高温度;
(4)计算该实验发生中和反应时放出的热量为1344J[中和后生成的溶液的比热容c=4.2J•(g•℃)-1,稀溶液的密度都为1g•cm-3];
(5)若用50mL 0.55mol•L-1的氨水(NH3•H2O)代替NaOH溶液进行上述实验,通过测得的反应热来计算中和热,测得的中和热△H会偏大(填“偏大”、“偏大”或“不变”),其原因是一水合氨为弱电解质,反应过程中电离需要吸收热量,故放出的热量偏少,△H偏大.
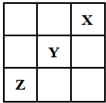 短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )| A. | Y的氢化物稳定性大于Z的氢化物稳定性 | |
| B. | Z一定是活泼的金属元素 | |
| C. | Y的最高价氧化物的水化物是一种强酸 | |
| D. | 1molX的单质可以跟足量水反应,转移的电子为2mol |
 ,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构.下列比较中,正确的是( )
,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构.下列比较中,正确的是( )| A. | 原子序数:a>b>c | B. | 单质的活泼性:a>c>d | ||
| C. | 原子半径:c>a>d | D. | 最高价含氧酸的酸性:d>c>a |
| A. | 0.01molFeCl3与沸水反应,形成Fe(OH)3胶粒数目小于0.01NA | |
| B. | 常温下,27g铝片加入足量浓硝酸中,转移的电子数目为3NA | |
| C. | 1mol甲苯含有6NA个C-H键 | |
| D. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
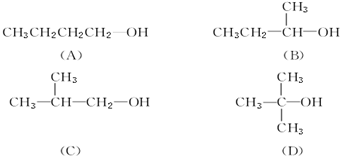
 .
.