题目内容
14.a、b、c、d是四种短周期元素,a、b、d同周期;c、d同主族;a的原子结构示意图为 ,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构.下列比较中,正确的是( )
,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构.下列比较中,正确的是( )| A. | 原子序数:a>b>c | B. | 单质的活泼性:a>c>d | ||
| C. | 原子半径:c>a>d | D. | 最高价含氧酸的酸性:d>c>a |
分析 a、b、c、d是四种短周期的主族元素,a的原子结构示意图为: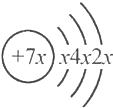 ,第一电子层最多排列2个电子,所以x=2,则a原子中质子数是14,故a为Si元素;a、b、d同周期,处于第三周期,c、d同主族,则C处于第二周期,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构,可推知b为Na、c为N,则d为P元素,结合元素周期律解答.
,第一电子层最多排列2个电子,所以x=2,则a原子中质子数是14,故a为Si元素;a、b、d同周期,处于第三周期,c、d同主族,则C处于第二周期,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构,可推知b为Na、c为N,则d为P元素,结合元素周期律解答.
解答 解:a、b、c、d是四种短周期的主族元素,a的原子结构示意图为: ,第一电子层最多排列2个电子,所以x=2,则a原子中质子数是14,故a为Si元素;a、b、d同周期,处于第三周期,c、d同主族,则C处于第二周期,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构,可推知b为Na、c为N,则d为P元素.
,第一电子层最多排列2个电子,所以x=2,则a原子中质子数是14,故a为Si元素;a、b、d同周期,处于第三周期,c、d同主族,则C处于第二周期,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构,可推知b为Na、c为N,则d为P元素.
A.由上述分析可知,原子序数a(Si)>b(Na)>c(N),故A正确;
B.同周期自左而右非金属性增强,故单质氧化性P>Si,氮气分子中存在三键,化学性质稳定,故B错误;
C.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径a(Si)>d(P)>c(N),故C错误;
D.非金属性:c(N)>d(P)>a(Si),故最高价含氧酸的酸性:c>d>a,故D错误,
故选A.
点评 本题考查原子结构和元素周期律,难度不大,推断元素是解题关键,侧重对基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.同周期的三种元素X、Y、Z,已知最高价氧化物的水化物酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断正确的是( )
| A. | 非金属性 Z>Y>X | B. | 原子半径 X>Y>Z | ||
| C. | 气态氢化物的稳定性 X>Y>Z | D. | 原子最外层电子数Z>Y>X |
9. 某学生利用物质间的互变,设计成一个平面魔方,如图所示:
某学生利用物质间的互变,设计成一个平面魔方,如图所示:
已知:
①A、B、C、D、G含有同种元素.
②E 是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀.B具有氧化性,液显黄色,能将SO2氧化为F(H2SO4),F与A反应生成E、G.
③
依据以上信息填空:
(1)请写出E的电子式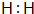 .
.
(2)D的化学式Fe2O3.
(3)请写出ABCDG所含的同种元素的原子结构示意图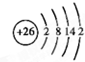 .
.
(4)G生成C的过程中所出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色
(5)写出A→B化学方程式:2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3
(6)B→F的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
 某学生利用物质间的互变,设计成一个平面魔方,如图所示:
某学生利用物质间的互变,设计成一个平面魔方,如图所示:已知:
①A、B、C、D、G含有同种元素.
②E 是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀.B具有氧化性,液显黄色,能将SO2氧化为F(H2SO4),F与A反应生成E、G.
③
| 纯A(单质) | B溶液 | C固体 | D固体 | G溶液 |
| 颜色 | 银白色(粉末状时为黑色)黄色红 | 褐色 | 红棕色 | 浅绿色 |
(1)请写出E的电子式
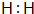 .
.(2)D的化学式Fe2O3.
(3)请写出ABCDG所含的同种元素的原子结构示意图
 .
.(4)G生成C的过程中所出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色
(5)写出A→B化学方程式:2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3
(6)B→F的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
6.下列物质既能发生加成反应、加聚反应、取代反应,又能发生氧化反应、还原反应的是( )
①
②
③
④CH=C-CH2-CH3
⑤
⑥CH2=CH-C2H5.
①

②

③

④CH=C-CH2-CH3
⑤

⑥CH2=CH-C2H5.
| A. | ②③⑤ | B. | ②④⑥ | C. | ③④⑥ | D. | ①②③④⑥ |
3.草毒、香蕉等水果具有芳香气味,是因为其中含有乙酸乙酯(化学式为C4H8O2)等物质,下列关于乙酸乙酷的说法不正确的是( )
| A. | 该物质属于氧化物 | |
| B. | 乙酸与乙醇反应生成乙酸乙酯属于取代反应 | |
| C. | 该物质的相对分子质量为88 | |
| D. | 乙酸乙酯燃烧有二氧化碳和水生成 |
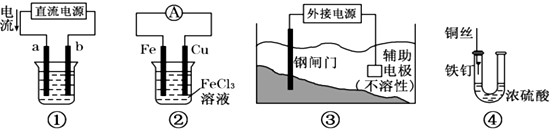
 某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.