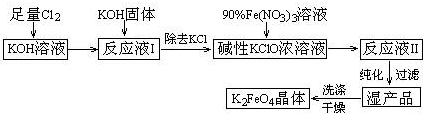
题目内容
15.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 0.01molFeCl3与沸水反应,形成Fe(OH)3胶粒数目小于0.01NA | |
| B. | 常温下,27g铝片加入足量浓硝酸中,转移的电子数目为3NA | |
| C. | 1mol甲苯含有6NA个C-H键 | |
| D. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
分析 A.依据胶体微粒是氢氧化铁的集合体分析;
B.常温下铝遇到浓硝酸发生钝化;
C.甲苯分子中含有8个H原子,则含有8个碳氢键;
D.氢氧化钠溶液中,氢氧根离子抑制了水的电离,则水电离的氢氧根离子浓度=氢离子浓度;
解答 解:A.胶体微粒是氢氧化铁的集合体,所以0.01molFeCl3与沸水反应,形成Fe(OH)3胶粒数目小于0.01NA,故A正确;
B.常温下铝遇到浓硝酸发生钝化,形成致密氧化膜,阻止反应进行,所以转移的电子数目小于3NA,故B错误;
C.1mol甲苯含有8NA个C-H键,故C错误;
D.氢氧化钠溶液中,氢氧根离子抑制了水的电离,溶液中的氢离子是水电离的,则水电离的氢氧根离子浓度=氢离子浓度=1×10-13mol/L,故D错误;
故选:A.
点评 注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确氢氧化钠溶液中的氢离子是水电离的,明确甲苯的结构是解题关键,注意浓硝酸的强氧化性.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列物质既能发生加成反应、加聚反应、取代反应,又能发生氧化反应、还原反应的是( )
①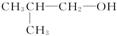
②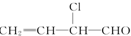
③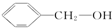
④CH=C-CH2-CH3
⑤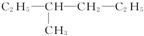
⑥CH2=CH-C2H5.
①
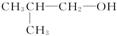
②
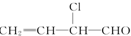
③
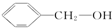
④CH=C-CH2-CH3
⑤
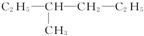
⑥CH2=CH-C2H5.
| A. | ②③⑤ | B. | ②④⑥ | C. | ③④⑥ | D. | ①②③④⑥ |
3.草毒、香蕉等水果具有芳香气味,是因为其中含有乙酸乙酯(化学式为C4H8O2)等物质,下列关于乙酸乙酷的说法不正确的是( )
| A. | 该物质属于氧化物 | |
| B. | 乙酸与乙醇反应生成乙酸乙酯属于取代反应 | |
| C. | 该物质的相对分子质量为88 | |
| D. | 乙酸乙酯燃烧有二氧化碳和水生成 |
10.下列有机物命名正确的是( )
| A. |  2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2C≡CH 1-丁炔 | ||
| C. |  间二甲苯 间二甲苯 | D. |  2-甲基-2-丙烯 2-甲基-2-丙烯 |
11.某化学兴趣小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答:
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度(或反应物浓度),反应速率增大.
(2)利用实验1数据计算,用KMnO4的浓度变化表示反应速率 (KMnO4)=1.5×10-2mol•L-1•min-1或0.015 mol•L-1•min-1.
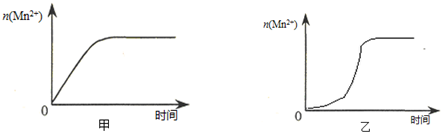
(3)该小组同学根据经验绘制了 (Mn2+) 随时间变化趋势的示意图,如图甲所示.但有同学查阅已有的实验资料发现,该实验过程中 (Mn2+) 随时间变化的趋势应如图乙所示. 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究.
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并选择表中空白处应加入的物质.
A.KMnO4 B.H2C2O4 C.K2SO4 D.MnSO4
③若该小组同学提出的假设成立,应观察到的现象是实验4与实验1比较,溶液褪色所需时间短 或:溶液褪色所用时间(t)小于4min.
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度(或反应物浓度),反应速率增大.
(2)利用实验1数据计算,用KMnO4的浓度变化表示反应速率 (KMnO4)=1.5×10-2mol•L-1•min-1或0.015 mol•L-1•min-1.
(3)该小组同学根据经验绘制了 (Mn2+) 随时间变化趋势的示意图,如图甲所示.但有同学查阅已有的实验资料发现,该实验过程中 (Mn2+) 随时间变化的趋势应如图乙所示. 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究.

①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并选择表中空白处应加入的物质.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | ||
③若该小组同学提出的假设成立,应观察到的现象是实验4与实验1比较,溶液褪色所需时间短 或:溶液褪色所用时间(t)小于4min.
 某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.