题目内容
15.将1.12g铁粉加入25mL 2mol/L的FeCl3溶液中,充分反应后,其结果是( )| A. | 铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变 | |
| B. | 往溶液中滴入无色KSCN溶液,不显红色 | |
| C. | Fe2+和Fe3+物质的量之比为6:1 | |
| D. | 氧化产物和还原产物的物质的量之比为2:5 |
分析 n(Fe)=$\frac{1.12g}{56g/mol}$=0.02mol,n(FeCl3)=c×V=2mol•L-1×0.025L=0.05mol,铁粉与氯化铁的离子反应方程式为:Fe+2Fe3+=3Fe2+,根据反应的物质的量之比等于计量数之比知,0.02mol铁粉完全反应需要0.04mol氯化铁,以此来解答.
解答 解:n(Fe)=$\frac{1.12g}{56g/mol}$=0.02mol,n(FeCl3)=c×V=2mol•L-1×0.025L=0.05mol,铁粉与氯化铁的离子反应方程式为:Fe+2Fe3+=3Fe2+,
A.0.02mol铁粉完全反应需要0.04mol氯化铁,所以氯化铁剩余0.01mol,Fe完全反应,Cl-基本保持不变,故A错误;
B.由于氯化铁剩余,向溶液中滴入无色KSCN溶液,显血红色,故B错误;
C.生成0.06molFe2+,氯化铁剩余0.01mol,则Fe2+和Fe3+物质的量之比为6:1,故C正确;
D.氧化产物、还原产物均为FeCl2,由电子守恒可知,1mol还原剂被氧化与2mol氧化剂被还原得失电子守恒,则氧化产物和还原产物的物质的量之比为1:2,故D错误;
故选C.
点评 本题考查铁的化学性质及氧化还原反应的计算,为高频考点,侧重分析与计算能力的考查,注意发生的离子反应及过量分析,题目难度不大.

练习册系列答案
相关题目
6.下列各组离子在溶液中能大量共存,且溶液为无色的是( )
| A. | Mg2+、Na+、SO42- | B. | K+、H+、HCO3- | C. | Cu2+、NO3-、SO42- | D. | Ba2+、NO3-、CO32- |
3.用惰性电极电解一定量的硫酸铜溶液,电解过程中的实验数据如图所示.横坐标表示转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况),下列判断正确的是( )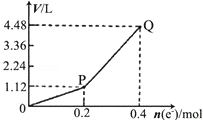

| A. | 电解过程中,溶液的pH不断增大 | |
| B. | Q点对应的气体中,H2与O2的体积比为2:1 | |
| C. | 阳极电极反应式为2H2O+4e-═4H++O2↑ | |
| D. | 当转移0.4mole-时,电解生成的铜为6.4g |
10.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| B. | 23g Na 与足量H2O反应完全后可生成NA个H2分子 | |
| C. | 标准状况下,22.4LN2和H2混合气中含NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去8 NA个电子 |
20.下列分散系能发生丁达尔效应的是( )
| A. | 泥水混合物 | B. | 食盐水 | C. | 蔗糖溶液 | D. | 烟、云、雾 |
4.通过该反应可制得ClO2:2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法不正确的是( )
| A. | H2C2O4在反应中作还原剂 | |
| B. | 该反应中氧化产物与还原产物的物质的量之比为1:1 | |
| C. | KClO3在反应中得到电子 | |
| D. | 1 molKClO3参加反应有2mol电子转移 |
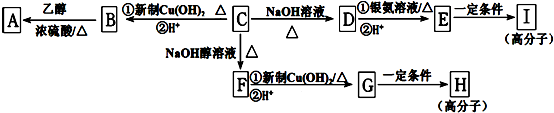
 ;
;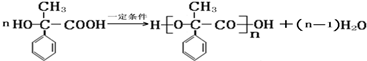 ,该反应类型是缩聚反应;
,该反应类型是缩聚反应; ,该反应类型是加聚反应;
,该反应类型是加聚反应; .
.