题目内容
1.氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:(1)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)═N2O4(l)△H1=-19.5kJ•mol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H2=-1048.9kJ•mol-1;
(2)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为N2H4-4e-+4OH-=N2+4H2O.
(3))科研人员新近开发出一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,可供手机连续使用一个月才充一次电,据此请回答以下问题:通入甲醇的是负极(填正或负),写出该电池的负极反应式_CH3OH-6e-+8OH-=CO32-+6H2O_.
(4)Zn-MnO2干电池应用广泛,电解质溶液是ZnCl2-NH4Cl混合溶液.
①该电池的负极材料是锌.电池工作时,电子流向正极(填“正极”或“负极”).
②若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是Zn与Cu2+生成Cu,Zn与Cu形成原电池加快反应速率.
③MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液.阳极的主要电极反应式是Mn2+-2e-+2H2O=MnO2+4H+. 若电解电路中通过4mol电子,标况下产生气体的物质的量为2mol.
分析 (1)根据盖斯定律,②×2-①可得目标热化学方程式;
(2)燃料电池中,从负极发生氧化反应的角度可知N2H4被氧化生成N2;
(3)燃料甲醇为原电池的负极,负极上发生氧化反应生成二氧化碳,在碱性条件下进上步生成碳酸根;
(4)①活泼金属做原电池的负极,原电池中电子从负极经外电路流向电源的正极;
②锌比铜活泼,能置换出铜,在电解质溶液中形成原电池反应加速锌的腐蚀;
③电解酸化的MnSO4溶液时,根据离子的放电顺序,阴极上首先放电的是H+,电极反应式为:2H++2e-=H2↑,阳极反应式为:Mn2+-2e-+2H2O=MnO2+4H+,根据电子转移与氢气的关系式计算.
解答 解:(1)肼可作为火箭发动机的燃料,与氧化剂N2H4反应生成N2和水蒸气,将方程式②×2-①得肼和N2H4 反应的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol,
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol;
(2)肼一空气燃料碱性电池中,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为:N2H4-4e-+4OH-=N2+4H2O,
故答案为:N2H4-4e-+4OH-=N2+4H2O;
(3)甲醇为原电池的负极,放电时,负极上甲醇失电子发生氧化反应生成碳酸根离子和水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:负;CH3OH-6e-+8OH-=CO32-+6H2O;
(4)①Zn-MnO2干电池中,活泼金属锌做原电池的负极,工作时原电池中电子从负极经外电路流向电源的正极,故答案为:锌,正极;
②锌比铜活泼,能置换出铜,反应为Zn+Cu2+=Zn2++Cu,形成原电池加速锌的腐蚀,
故答案为:Zn与Cu2+生成Cu,Zn与Cu 形成原电池加快反应速率;
③阳极上失电子,发生氧化反应,Mn2+得电子与水反应生成二氧化锰,根据电荷守恒得电极反应为Mn2+-2e-+2H2O=MnO2+4H+,阴极是氢离子得电子产生氢气,电极反应为2H++2e-=H2↑,因为MnSO4~MnO2~2e-~H2,通过4mol电子产生2molH2,
故答案为:Mn2+-2e-+2H2O=MnO2+4H+;2mol.
点评 本题考查了盖斯定律、原电池和电解池原理,明确元素化合价变化、氧化还原反应与电极反应式的关系是解本题关键,难点是电极反应式的书写,难度中等.

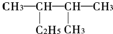 ,下列对该烷烃的系统命名中正确的是( )
,下列对该烷烃的系统命名中正确的是( )| A. | 3-甲基-2-乙基丁烷 | B. | 2-甲基-3-乙基丁烷 | ||
| C. | 2,3-二甲基戊烷 | D. | 3,4-二甲戊烷 |
| A. | 位于短周期的X元素的阳离子与Y元素的阴离子具有相同的电子层结构,则两元素的原子序数一定是X<Y | |
| B. | 共价化合物的熔沸点都比较低 | |
| C. | 热稳定性:AsH3<PH3<H2O<HF | |
| D. | 最外层电子数较少的金属元素,不一定比最外层电子数较多的金属元素活泼性强 |
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2 L | |
| B. | 25℃,1.01×105 Pa,32 g O2和O3的混合气体所含原子数为2.5NA | |
| C. | 标准状况下,11.2 L H2O含有的原子数为1.5NA | |
| D. | 常温常压下,44 g CO2含有的原子数为3NA |
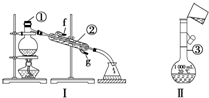 掌握仪器的名称及使用方法是化学实验的基础,如图所示为两套实验装置.
掌握仪器的名称及使用方法是化学实验的基础,如图所示为两套实验装置.