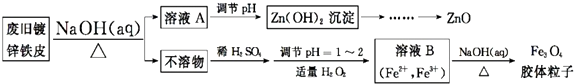
题目内容
9.在同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比1:1,原子总数之比为5:3,质量之比为4:11,密度之比为4:11.分析 根据阿伏加德罗定律定律比较分子数、物质的量之比,根据分子组成判断原子数目的多少,根据m=n•M计算质量,根据同温同压下,气体的密度之比等于相对分子质量之比比较密度.
解答 解:根据阿伏加德罗定律定律,相同条件下,相同体积的任何气体都含有相同的数目的粒子,
则:同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为1:1;
根据N=n•NA可知:物质的量之比为1:1;
1个甲烷分子中含有5个原子,1个二氧化碳分子中含有3个原子,则原子总数之比为5:3;
根据m=n•M可知,物质的量相同时,质量之比等于相对分子质量之比,则质量之比为16:44=4:11;
根据同温同压下,气体的密度之比等于相对分子质量之比,则密度之比为4:11.
故答案为:1:1;5:3;4:11;4:11.
点评 本题考查物质的量的有关计算以及阿伏加德罗定律及推论的应用,题目难度不大,注意物质的量与质量、体积、微粒数目之间的计算公式的运用.

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
20.下列应用不涉及氧化还原反应的是( )
| A. | Na2O2用作呼吸面具的供氧剂 | B. | 实验室制二氧化碳 | ||
| C. | 工业上利用合成氨实现人工固氮 | D. | 工业上电解熔融状态Al2O3制备Al |
17.下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )
| 选项 | 微粒组 | 所加试剂 | 离子方程式 |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH-═BaSO4↓+2NH3•H2O |
| B | Mg2+、Cl-、HCO3- | 过量NaOH溶液 | Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O |
| C | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+═SO2↑+H2O |
| D | K+、CO32-、NH3•H2O | 通入少量CO2 | CO32-+CO2+2H2O═2HCO3- |
| A. | A | B. | B | C. | C | D. | D |
14.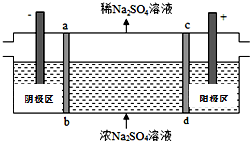 三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )
 三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )| A. | 通电后中间隔室的SO42-离子向正极迁移,正极区溶液碱性增强 | |
| B. | 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 | |
| C. | 阴极区溶液pH降低,阳极区溶液pH升高 | |
| D. | 当电路中通过1mol电子的电量时,会有0.5mol的O2生成 |
19.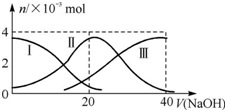 常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )
常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )
 常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )
常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )| A. | 当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) | |
| B. | 等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水小 | |
| C. | NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) | |
| D. | 向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减小 |