题目内容
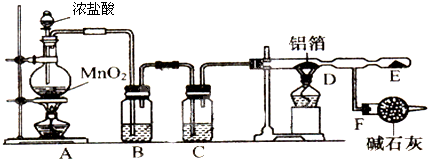
5.1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O.现将17.4g MnO2与足量浓盐酸完全反应(杂质不参加反应),计算:生成的Cl2的体积(标准状况)分析 根据n=$\frac{m}{M}$计算二氧化锰的物质的量,根据方程式计算生成的氯气的物质的量,利用V=nVm计算氯气的体积.
解答 解:17.4gMnO2的物质的量=$\frac{17.4g}{87g/mol}$=0.2mol,则:
设生成的Cl2的体积为V,
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1mol 22.4L
0.2mol V
所以,V=$\frac{0.2mol×22.4L}{1mol}$=4.48L,
答:生成的Cl2的体积在标准状况下为4.48L.
点评 本题考查根据化学方程式的相关计算,题目难度不大,旨在考查学生对基础知识的理解掌握.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
13.化合物X是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( )
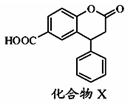

| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和Na2CO3溶液反应 | |
| C. | 在酸性条件下水解,水解产物只有一种 | |
| D. | 1mol化合物X最多能与7molH2反应 |
20.下列各组物质,前者属于电解质,后者属于非电解质的是( )
| A. | NaCl晶体、BaSO4 | B. | 铜、二氧化硫 | C. | 硫酸溶液、HCl | D. | 熔融的KNO3、酒精 |
10.Na2O2是中学化学常用试剂,下列说法错误是( )
| A. | 0.1mol Na2O2与足量CO2反应转移的电子的物质的量为0.1mol | |
| B. | 将Na2O2粉末加入到饱和NaOH溶液中,OH-离子浓度一定不变 | |
| C. | 等物质的量的Na2O2与Na2O溶于等质量水中得到的NaOH的物质的量浓度相同 | |
| D. | 等质量的Na2O2与Na2S晶体中含有相同数目的阴离子 |
17. 某班学生用0.1mol•L-1盐酸和0.1mol•L-1NaOH溶液反应测定酸碱滴定曲线,甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,下列说法错误的是( )
某班学生用0.1mol•L-1盐酸和0.1mol•L-1NaOH溶液反应测定酸碱滴定曲线,甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,下列说法错误的是( )
 某班学生用0.1mol•L-1盐酸和0.1mol•L-1NaOH溶液反应测定酸碱滴定曲线,甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,下列说法错误的是( )
某班学生用0.1mol•L-1盐酸和0.1mol•L-1NaOH溶液反应测定酸碱滴定曲线,甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,下列说法错误的是( )| A. | 乙组同学操作上的不足是在滴定终点附近测试和记录pH的间隔太大 | |
| B. | 甲组同学滴定时选用的滴定管为酸式滴定管 | |
| C. | 乙和丙两组同学的操作均存在不足或失误 | |
| D. | 丙组同学可能是用待测液润洗了锥形瓶 |
14.某烷烃只能生成一种一氯化物,此烷烃的分子式不可能是( )
| A. | CH4 | B. | C4H10 | C. | C5H12 | D. | C8H18 |
20.己知某溶液中含有C1-,Br-和CrO42-,浓度均为0.010mo1•L-1,向该溶液中逐滴加入0.010mol•L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12.
Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12.
| A. | C1-、Br-、CrO42- | B. | CrO42-、Br-、C1- | C. | Br-、C1-、CrO42- | D. | Br-、CrO42-、C1- |