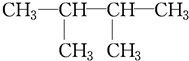题目内容
某温度时,在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示: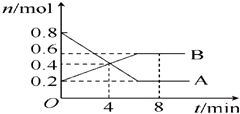
由图中数据分析求:
(1)该反应的化学方程式为 .
(2)反应开始至4min时,B的平均反应速率为 .
(3)4min时,正、逆反应速率的大小关系为:v(正) v(逆) (填“>”、“<”或“=”,下同),8min时,v(正) v(逆).
(4)4min时,A的转化率为 .

由图中数据分析求:
(1)该反应的化学方程式为
(2)反应开始至4min时,B的平均反应速率为
(3)4min时,正、逆反应速率的大小关系为:v(正)
(4)4min时,A的转化率为
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)根据v=
计算反应速率;
(3)4min时,反应未达到平衡状态,反应正向进行,据此判断正逆速率的关系;8min时,反应达到平衡状态;
(4)A的转化率=
×100%,据此判断.
(2)根据v=
| △c |
| △t |
(3)4min时,反应未达到平衡状态,反应正向进行,据此判断正逆速率的关系;8min时,反应达到平衡状态;
(4)A的转化率=
| n(转化量) |
| n(起始量) |
解答:
解:(1)由图象可以看出,反应中A的物质的量减小,B的物质的量增多,则A为反应物,B为生成物,
且△n(A):△n(B)=(0.8mol-0.2mol):(0.6mol-0.2mol)=3:2,则反应的化学方程式为:3A?2B;
故答案为:3A?2B;
(2)反应开始至4min时,B的物质的量变化为0.4mol-0.2mol=0.2mol,则v(B)=
=
=0.025mol/(L?min);
故答案为:0.025mol/(L?min);
(3)4min时,反应未达到平衡状态,反应正向进行,所以v(正)>v(逆);8min时,各反应物的物质的量不再变化,反应达到平衡状态,则v(正)=v(逆);
故答案为:>;=;
(4)4min时,参加反应的A为0.8mol-0.4mol=0.4mol,则A的转化率=
×100%=
×100%=50%,故答案为:50%.
且△n(A):△n(B)=(0.8mol-0.2mol):(0.6mol-0.2mol)=3:2,则反应的化学方程式为:3A?2B;
故答案为:3A?2B;
(2)反应开始至4min时,B的物质的量变化为0.4mol-0.2mol=0.2mol,则v(B)=
| ||
| t |
| ||
| 4min |
故答案为:0.025mol/(L?min);
(3)4min时,反应未达到平衡状态,反应正向进行,所以v(正)>v(逆);8min时,各反应物的物质的量不再变化,反应达到平衡状态,则v(正)=v(逆);
故答案为:>;=;
(4)4min时,参加反应的A为0.8mol-0.4mol=0.4mol,则A的转化率=
| n(转化量) |
| n(起始量) |
| 0.4mol |
| 0.8mol |
点评:本题考查化学平衡图象分析题目,涉及反应方程式的确定、反应速率的计算、转化率的计算等,题目难度中等,注意分析各物质的量的变化曲线,把握化学方程式的判断方法.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
据报道:用激光可将置于铁室中的石墨靶上的碳原子“炸松”,再用一个射频电火花喷射出氮气,可使碳、氮原子结合成碳氮化合物(C3N4)的薄膜,该碳氮化合物比金刚石还坚硬,则下列说法正确的是( )
| A、该碳氮化合物呈片层状结构 |
| B、该碳氮化合物呈立体网状结构 |
| C、该碳氮化合物中C-N键键长大于金刚石中C-C键键长 |
| D、相邻主族非金属元素形成的化合物的硬度比单质小 |
 系统命名为
系统命名为 的炔烃的结构简式
的炔烃的结构简式 系统命名为
系统命名为 某校化学实验小组同学进行有关NO2气体的系列实验.
某校化学实验小组同学进行有关NO2气体的系列实验.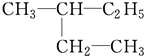 和
和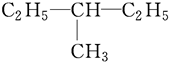
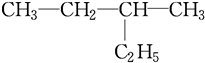 和
和