题目内容
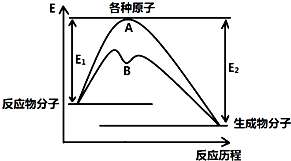 已知某反应在不同条件下的反应历程可以表示成如图所示,E1表示反应物分子变成原子所吸收的热量,E2表示这些原子重新成键形成生成物放出的热量,请回答下列问题:
已知某反应在不同条件下的反应历程可以表示成如图所示,E1表示反应物分子变成原子所吸收的热量,E2表示这些原子重新成键形成生成物放出的热量,请回答下列问题:(1)据图判断该反应是
A.增大反应物的浓度 B.降低温度 C.增大压强 D.使用催化剂
(2)下表给出了一些化学键的键能:
| 化学键 | H-H | Cl-Cl | O=O | O-H | H-Cl |
| 键能(kJ?mol-1) | 436 | 247 | x | 463 | 431 |
②催化剂、加热条件下可用氧气与氯化氢气体反应置换出氯气,同时生成另一种气态化合物,利用上表数据写出该热化学方程式
考点:反应热和焓变,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题
分析:(1)依据图象分析反应物的能量大于生成物的能量,反应放热;放热反应升温时,平衡逆向移动,反应物转化率降低;B历程比A历程反应的活化能低,说明加了催化剂;
(2)①利用△H=反应物键能和-生成物键能和解答;②先写出化学方程式,然后根据焓变=反应物的总键能-生成物的总键能计算焓变;据热化学方程式分析出△H的值与转移电子数的关系解答.
(2)①利用△H=反应物键能和-生成物键能和解答;②先写出化学方程式,然后根据焓变=反应物的总键能-生成物的总键能计算焓变;据热化学方程式分析出△H的值与转移电子数的关系解答.
解答:
解:(1)依据图象分析反应物的能量大于生成物的能量,反应放热;放热反应升温时,平衡逆向移动,反应物转化率降低;B历程比A历程反应的活化能低,说明加了催化剂故答案为:放;减小;D;
(2)①△H=反应物键能和-生成物键能和,则有436+
x-2×431=-241.8,x=496.4,故答案为:496.4;
②上述反应的化学方程式为O2(g)+4HCl(g)=2Cl2(g)+2H2O(g),△H=反应物键能和-生成物键能和=464.4KJ/mol+4×431KJ/mol-2×247KL/mol-4×463KJ/mol=-125.6KJ/mol,所以,其热化学方程式为:O2(g)+4HCl(g)=2Cl2(g)+2H2O(g)△H=-126.5KJ/mol;上述反应1molO2反应转移4mol电子,反应物的活化能,464.4KJ/mol+4×431KJ/mol=2220.4KJ/mol,所以当有1mol电子转移时吸收的能量为555.1KJ,
故答案为:O2(g)+4HCl(g)=2Cl2(g)+2H2O(g)△H=-126.5KJ/mol;555.1.
(2)①△H=反应物键能和-生成物键能和,则有436+
| 1 |
| 2 |
②上述反应的化学方程式为O2(g)+4HCl(g)=2Cl2(g)+2H2O(g),△H=反应物键能和-生成物键能和=464.4KJ/mol+4×431KJ/mol-2×247KL/mol-4×463KJ/mol=-125.6KJ/mol,所以,其热化学方程式为:O2(g)+4HCl(g)=2Cl2(g)+2H2O(g)△H=-126.5KJ/mol;上述反应1molO2反应转移4mol电子,反应物的活化能,464.4KJ/mol+4×431KJ/mol=2220.4KJ/mol,所以当有1mol电子转移时吸收的能量为555.1KJ,
故答案为:O2(g)+4HCl(g)=2Cl2(g)+2H2O(g)△H=-126.5KJ/mol;555.1.
点评:本题考查了化学反应的能量变化与反应的焓变关系的分析判断,反应活化能的判断计算,图象的综合应用,读懂图象,焓变和活化能计算方法的理解是解题的关键.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
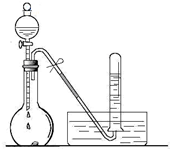 某校化学实验小组同学进行有关NO2气体的系列实验.
某校化学实验小组同学进行有关NO2气体的系列实验.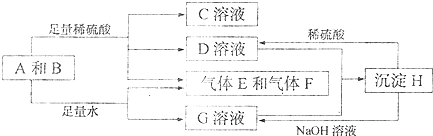
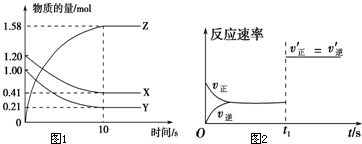 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图1所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图1所示: A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.