题目内容
5.将12g铁片放入150ml的CuSO4溶液中,当溶液中的Cu2+全部被还原时,铁片质量增加0.3g,则原CuSO4溶液的物质的量浓度是( )| A. | 0.125mol/L | B. | 0.175 mol/L | C. | 0.25 mol/L | D. | 0.50 mol/L |
分析 根据发生的反应:Fe+CuSO4═FeSO4+Cu,利用差量法来计算溶液中硫酸铜的物质的量,依据C=$\frac{n}{V}$计算硫酸铜的物质的量浓度.
解答 解:设原溶液中硫酸铜的物质的量为xmol,则:
Fe+CuSO4═FeSO4+Cu△m
1mol 8g
xmol 0.3g
1mol:xmol=8g:0.3g
解得x=0.0375,
硫酸铜的物质的量浓度=$\frac{0.0375mol}{0.15L}$=0.25mol/L,故选:C.
点评 本题考查了有关方程式的计算,明确铁片增加的质量为“析出铜和溶解铁的质量差”是解本题关键,题目难度不大.

练习册系列答案
相关题目
15.下列离子组能大量共存的是( )
| A. | Fe3+、K+、OH-、Cl- | B. | Na+、Zn2+、CO32-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ba2+、CO32-、NO3-、K+ |
16.在一个容积固定的反应容器中有一可左右滑动的密封隔板,将反应容器分甲、乙两室,甲室充入的是氢气与氯气,共2mol,乙室充入的是一氧化碳与氧气也共2mol,在一定条件下充分反应恢复到起始状态,反应前后变化如图所示:则起始时乙中一氧化碳与氧气的体积比可能为( )

| A. | 1:2 | B. | 4:3 | C. | 2:1 | D. | 3:1 |
13.下列各组物质含有的化学键类型完全相同的是( )
| A. | HBr、CO2、NH3 | B. | Na2O、Na2O2、Na2S | C. | NaCl、HCl、H2O | D. | NaOH、CaCl2 |
20.下列说法正确的是( )
| A. | 蒸发皿加热时均需要垫上石棉网 | |
| B. | 分液漏斗使用前均需要检查是否漏水 | |
| C. | 配制1 mol•L-1NaCl溶液、测定Na2CO3溶液的pH、焰色反应实验均需要用到玻璃棒 | |
| D. | 氯水存放在配有磨口塞的广口瓶中 |
10.下列物质分类正确的是( )
| A. | SO2、SiO2、P2O5均为酸性氧化物 | |
| B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| C. | 酒精、冰醋酸、草酸钾均为电解质 | |
| D. | NH4SCN、SiO2、NH3•H2O均为共价化合物 |
17.某短周期元素原子的最外电子层只有2个电子,该元素可能是( )
| A. | VIIA族元素 | B. | VIA族元素 | C. | 第三周期元素 | D. | IA族元素 |
14.常温时,用0.1000mol/L NaOH溶液滴定25.00mL 0.1000mol/L某一元酸HX溶液,滴定过程中pH变化曲线如图所示.下列说法不正确的是( )
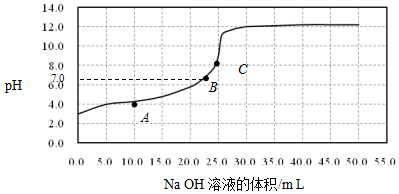

| A. | 在A点:c(HX)>c(Na+)>c(X-) | |
| B. | 在B点,溶液中c(H+)=c(OH-) | |
| C. | C点溶液中存在的主要平衡是X-+H2O?HX+OH- | |
| D. | 0.05mol/L NaX溶液的pH≈9 |
15.兵马俑中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法错误的是( )
| A. | x等于6 | |
| B. | 性质稳定,不易脱色 | |
| C. | 易溶解于强酸和强碱 | |
| D. | 可用氧化物形式表示为BaO•CuO•2SiO2 |