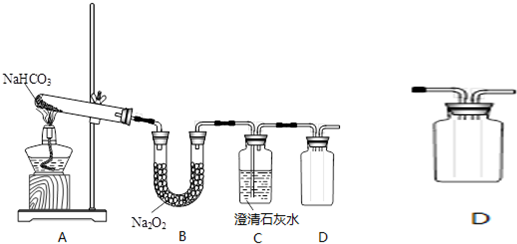
题目内容
4.人造地球卫星用到的一种高能电池-银锌电池,它在放电时的电极反应为:Zn+2OH--2e-═ZnO+H2O,
Ag2O+H2O+2e-═2Ag+2OH-
据此判断,下列说法正确的是( )
| A. | Ag2O作正极,被氧化 | |
| B. | 若将电解液换成酸性溶液,使用寿命会缩短 | |
| C. | Zn作正极,被还原 | |
| D. | OH-向正极移动 |
分析 原电池放电时,负极上失电子发生氧化反应,正极上得电子发生还原反应,根据电极反应式知,锌作负极,氧化银作正极,原电池放电时,电解质溶液中阳离子向正极移动,阴离子向负极移动,电流从正极流向负极.
解答 解:A.氧化银得电子发生还原反应,被还原,所以氧化银是正极,故A错误;
B.该电池的负极为活泼金属Zn,Zn能与酸发生反应,所以若将电解液换成酸性溶液,使用寿命会缩短,故B正确;
C.锌失电子作负极,Zn的化合价升高发生氧化反应,故C错误;
D.放电时,氢氧根离子向负极移动,钾离子和氢离子向正极移动,故D错误;
故选B.
点评 本题考查了原电池原理,明确正负极上得失电子、电解质溶液中离子移动方向、电流的方向即可解答,难度不大.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
15.有8种物质:①甲烷;②苯;③聚乙烯;④聚1,3-丁二烯;⑤2-丁炔;⑥环己烷;⑦邻二甲苯;⑧环己烯.既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
| A. | ③④⑤⑧ | B. | ④⑤⑧ | C. | ④⑤⑦⑧ | D. | ③④⑤⑦⑧ |
12.下列关于化学反应的描述中正确的是( )
| A. | 当一个化学反应在一定条件下达到最大限度时,反应速率也最大 | |
| B. | 用一定量的锌片和足量的稀硫酸反应制氢气时,加入少量氧化铜,可以加快反应的速率且生成氢气的总量不变 | |
| C. | 燃烧一定是放热反应,也是氧化还原反应 | |
| D. | 化学反应中能量变化的大小与反应物的状态无关 |
19.几种短周期元素的原子半径及主要化合价如下表
下列说法正确的是( )
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A. | 离子半径r(R3-)>r(X+)>r(Z3+) | |
| B. | 元素X和Q形成的化合物中不可能含有共价键 | |
| C. | Q2-比R3-更容易失去电子 | |
| D. | Y的含氧酸的酸性一定比R的含氧酸的酸性强 |
13.下列装置能构成原电池的是( )
| A. | 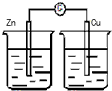 稀H2SO4 | B. | 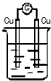 AgNO3 | C. | 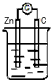 甘油 | D. | 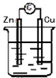 稀H2SO4 |
14.下列表述正确的是( )
| A. | Na2O2固体中阴、阳离子个数比为1:1 | |
| B. | 由酸性HCl>H2CO3,可推知非金属性Cl>C | |
| C. | pH均为5的CH3COOH溶液和NH4Cl溶液中水的电离程度相同 | |
| D. | 常温下,浓度均为0.1mol/L的HA酸溶液与NaOH溶液等体积混合后(pH约为8),溶液中离子浓度关系:c(Na+)>c(A-)>c(OH-)>c(H+) |
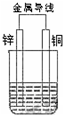 如图所示原电池
如图所示原电池