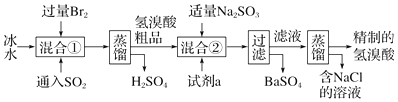
题目内容
6.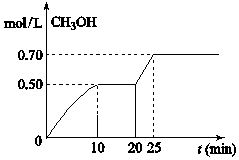 在容积固定为2L的密闭容器中,充入2molCO2和6molH2,在温度500℃时发生反应,CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0,CH3OH的浓度随时间变化如右图,下列说法正确的是( )
在容积固定为2L的密闭容器中,充入2molCO2和6molH2,在温度500℃时发生反应,CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0,CH3OH的浓度随时间变化如右图,下列说法正确的是( )| A. | 从开始到25分钟,CO2的转化率是35% | |
| B. | 从20分钟到25分钟,可能是缩小容器体积 | |
| C. | 其它条件不变,将温度升到800℃,平衡常数增大 | |
| D. | 从反应开始到10分钟,H2的平均反应速率v(H2)=0.15mol(L•min) |
分析 A.从开始到25分钟,生成CH3OH(g)为0.70mol/L,由反应可知转化的CO2(g)为0.70mol/L,结合转化率=$\frac{转化的量}{开始的量}$×100%计算;
B.该反应为气体体积减小反应,增大压强平衡正向移动,且反应速率增大,从20分钟到25分钟时,若增大压强,需要缩小容器体积,甲醇浓度变化不会逐渐变化,应该立即变化;
C.该反应为放热反应,升高温度,平衡逆向移动;
D.从反应开始到10分钟,生成CH3OH(g)为0.50mol/L,则消耗氢气为1.5mol/L.
解答 解:A.从开始到25分钟,生成CH3OH(g)为0.70mol/L,由反应可知转化的CO2(g)为0.70mol/L,则CO2的转化率是$\frac{0.7mol/L}{\frac{2mol}{2L}}$×100%=70%,故A错误;
B.20分钟到25分钟达到新的平衡,因为左边的化学计量数之后大于右边,所以压强增大,CH3OH的含量增高,但是当压强增大,浓度应该立即增大,不会有渐变过程,故B错误;
C.该反应为放热反应,升高温度,平衡逆向移动,则平衡常数K减小,故C错误;
D.从反应开始到10分钟,生成CH3OH(g)为0.50mol/L,则消耗氢气为1.5mol/L,H2的平均反应速率v(H2)=$\frac{1.5mol/L}{10min}$=0.15mol(L•min),故D正确;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握图中浓度的变化、转化率的计算、温度和压强对反应的影响为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的难点,题目难度不大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
16.下列说法正确的是( )
| A. | 将pH均为a的NaOH溶液和氨水分别加水稀释100倍,pH分别变为b和c,则a、b、c的大小关系为b>c>a | |
| B. | 常温下0.1 mol•L-1 KHA溶液的pH=3,则该溶液中C(A2- )<c(H2A) | |
| C. | 室温时 M(OH)2(s)?M2+(aq)+2OH-(aq) Ksp=a,则当 c(M2+)=b mol•L-1 时,溶液的pH为14+$\frac{1}{2}$1g$\frac{a}{b}$ | |
| D. | 0.1 mol•L-1Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) |
17.部分短周期元素的性质或原子结构如表所示.下列叙述不正确的是( )
| 元素代号1 | 元素的性质或原子结构 |
| W | M层上的电子数为4 |
| X | 常温下,其单质为双原子分子,其氢化物的水溶液呈碱性 |
| Y | L层电子数为次外层电子数的3倍 |
| Z | 元素最高正价是+7价 |
| A. | 化合物WY2不溶于水 | |
| B. | 原子半径:W>X>Y | |
| C. | 最高价氧化物对应水化物的酸性:W<Z | |
| D. | 由X、Y和氢三种元素形成的所有化合物中只含共价键 |
14.下列装置(部分夹持仪器略去)或操作正确的是( )
| A. | 除去乙块中的H2S | B. | 检验是否存在苯酚 | ||
| C. |  银镜反应 | D. |  中和滴定 |
1.下列有关生活中常见物质的说法正确的是( )
| A. | 一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应 | |
| B. | 乙二醇、丙氨酸均可发生缩聚反应 | |
| C. | 从海水中提取镁、溴、碘及从海水中生产烧碱、食盐、纯碱的过程中均涉及氧化还原反应 | |
| D. | 自然界中含有大量的游离态的硅,硅单质可用于制作计算机芯片 |
10.用下列实验装置进行相应实验,下列说法正确的是( )
| A. |  用如图所示装置分离沸点相差较大的互溶液体混合物 | |
| B. |  用如图所示装置除去NaCO3固体中混有的NaHCO3 | |
| C. |  用如图所示装置除去Cl2中含有的HCl | |
| D. |  用如图所示装置进行电解法制离Cl2和H2 |
7.化学无处不在,下列与化学有关的说法正确的是( )
| A. | 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3 | |
| B. | 乙醇溶液和双氧水均可用于杀菌消毒,其原理相同 | |
| C. | 用玻璃棒蘸取酸性高锰酸钾溶液,滴在pH试纸上,然后与标准比色卡对照,测其pH | |
| D. | “一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称,丝绸的主要成分是天然纤维素,属于高分子化合物 |
8.下列关于有机化合物的说法正确的是( )
| A. | 糖类、油脂和蛋白质在一定条件下一定都能水解 | |
| B. | 除去乙醇中的乙酸用分液的方法 | |
| C. | C5H10O2能与NaHCO3反应的结构有4种 | |
| D. | C8H10的同分异构体有三种,它们的性质相似 |