��Ŀ����
5������п�̵����һ�ָ�Ч��һ�ε�أ����Ϊ����п���м���ʯī������MnO2Ϊ������Ӧ��KOH��Һ��Ϊ�������Һ�����ɼ���п�̵�ػ���һЩ���ʣ���֪Zn2+��Mn2+������ph��Χ���±���ʾ��| ���� | ��ʼ���� | ������ȫ |
| Zn2+ | 5.7 | 6.2 |
| Mn2+ | 8.2 | 9.7 |
��1���õ�ص�������ӦΪMnO2+e-+H+�TMnOOH���ܷ�ӦΪZn+2MnO2+2H+�TZn2++2MnOOH��
��2���õ����ת��0.2mol����ʱ������MnO2������Ϊ17.4g��
��3�����õ�صĸ������Ϻ�MnO2��������Ũ���Ṳ�ȣ�����MnO2���뷴Ӧ�����ӷ���ʽΪMnO2+4H+��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O����ʹMn2+��Zn2+���룬�����pHΪ6.2��pH��8.2�����Լ���Mn��OH��2����pH��
��4���ټ�������pH�ɵõ�Mn��OH��2���ó����ڿ����п���Ѹ�ٱ�������MnO2��д���˷�Ӧ�Ļ�ѧ����ʽ2Mn��OH��2+O2=2MnO2+2H2O��
��5������Mn2+������ȫ��pH�������Mn��OH��2��KspԼΪ10-24.4��
���� ��1���õ�ص�����������ԭ��Ӧ��MnO2����ԭ����MnOOH������п����������Zn2+���Դ���д����ܷ�Ӧʽ��
��2�����ݵ缫����ʽ�е�����������̵Ĺ�ϵ���㣻
��3������������Ũ���ᷴӦ�����Ȼ��̡�������ˮ������ Zn2+�� Mn2+�γɳ�����pH��������������������������Ӷ��Ҳ��������µ����ʣ�
��4��Mn��OH��2��O2��Ӧ����MnO2��
��5���ó�����ȫʱ����Ũ��С��1��10-5mol•L-1������Ksp=c��Mn2+����c2��OH-�����㣮
��� �⣺��1���õ�ص�����������ԭ��Ӧ��MnO2����ԭ����MnOOH���缫����ʽΪMnO2+H++e-=MnOOH������п����������Zn2+������ܷ�ӦʽΪ2MnO2+Zn+2H+=2MnOOH+Zn2+��
�ʴ�Ϊ��MnO2+e-+H+�TMnOOH��Zn+2MnO2+2H+�TZn2++2MnOOH��
��2�������ĵ缫����ʽΪMnO2+H++e-=MnOOH����ת��0.2mol����ʱ������MnO2�����ʵ���Ϊ0.2mol��������Ϊ02��mol��87g/mol=17.4g��
�ʴ�Ϊ��17.4��
��3������������Ũ���ᷴӦ�����Ȼ��̡�������ˮ���䷴Ӧ�����ӷ���ʽΪ��MnO2+4H+��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O�� ��ʹMn2+��Zn2+���룬�����pHʹZn2+��ȫ��������Mn2+�����γɳ������ɱ������ݿ�֪��pHΪ��6.2��pH��8.2���ڵ���pHʱ����������������������Ӷ��Ҳ��������µ����ʣ����Լ���Mn��OH��2������pH��
�ʴ�Ϊ��MnO2+4H+��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O��6.2��pH��8.2��Mn��OH��2��
��4��Mn��OH��2��O2��Ӧ����MnO2���䷴Ӧ�ķ���ʽΪ��2Mn��OH��2+O2=2MnO2+2H2O��
�ʴ�Ϊ��2Mn��OH��2+O2=2MnO2+2H2O��
��5���ó�����ȫʱ����Ũ��С��1��10-5mol•L-1��Mn2+������ȫ��pH=9.7����Ksp=c��Mn2+����c2��OH-��=1��10-5����10-9.7��2=10-24.4��
�ʴ�Ϊ��10-24.4��
���� ���⿼��ԭ���֪ʶ�����ʵķ����ᴿ�Լ��ܶȻ����йؼ��㣬������ԭ��صĹ���ԭ���Լ�ʵ�����������ע�����⣬��Ŀ�Ѷ��еȣ�����������ѧ�����õĿ�ѧ������

| A�� | NO | B�� | NO2 | C�� | N2O | D�� | N2O3 |
| A�� |  ��ʾ��ϩ�ļ���ʽ ��ʾ��ϩ�ļ���ʽ | B�� |  ��ʾ����������ģ�� ��ʾ����������ģ�� | ||
| C�� | C2H4O2��ʾ����ķ���ʽ | D�� |  34S2-�Ľṹʾ��ͼ 34S2-�Ľṹʾ��ͼ |
| A�� | C10H9Cl3O2 | B�� | C10H9Cl2O2 | C�� | C10H12Cl3O2 | D�� | C10H17Cl3O2 |
| A�� | ��KIO3����������Һ�е�KI��5I-+IO3-+3H2O�T3I2+6OH- | |
| B�� | FeCl3��Һ��Cu�ķ�Ӧ��Cu+Fe3+�TCu2++Fe2+ | |
| C�� | ������������Һ��ȥ�����������Ĥ��Al2O3+2OH-�T2AlO2-+H2O | |
| D�� | ��������ͨ��FeI2��Һ�У�3Cl2+2I-+4Fe2+�TI2+4Fe3++4Cl- |
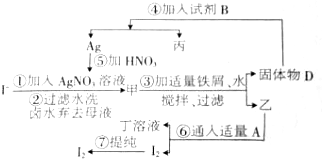 ���Ѿ���ȡ�Ȼ��ơ��塢þ�Ȼ�ѧ���ʵĸ���±ˮ�У�����ͼʾ�Ĺ��������������ʵ⣺
���Ѿ���ȡ�Ȼ��ơ��塢þ�Ȼ�ѧ���ʵĸ���±ˮ�У�����ͼʾ�Ĺ��������������ʵ⣺
 ��ͼ��ij����X������H2��CO��CH4�е�һ�ֻ�����ɣ���X����ȼ�գ���ȼ�պ����ɵ�����ͨ��A��B����ϴ��ƿ���Իش��������⣺
��ͼ��ij����X������H2��CO��CH4�е�һ�ֻ�����ɣ���X����ȼ�գ���ȼ�պ����ɵ�����ͨ��A��B����ϴ��ƿ���Իش��������⣺