题目内容
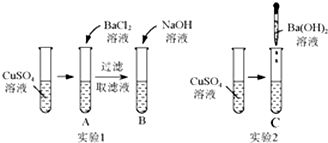 仔细分析如图中的实验:
仔细分析如图中的实验:A、B、C试管中的现象如表所示:
| A | B | C |
| 产生白色沉定, 溶液仍为蓝色 | 产生蓝色沉定, 溶液变为无色 | 产生蓝色沉淀, 溶液为无色 |
A.
考点:离子方程式的书写
专题:
分析:氯化钡与硫酸铜反应生成白色硫酸钡沉淀和氯化铜;
氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠;
氢氧化钡与硫酸铜反应生成硫酸钡和氢氧化铜沉淀.
氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠;
氢氧化钡与硫酸铜反应生成硫酸钡和氢氧化铜沉淀.
解答:
解:A.氯化钡与硫酸铜反应生成白色硫酸钡沉淀和氯化铜,离子方程式为:Ba2++SO42-=BaSO4↓;
故答案为:Ba2++SO42-=BaSO4↓;
B.氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,离子方程式为:Cu2++2OH-═Cu(OH)2↓;
故答案为:Cu2++2OH-═Cu(OH)2↓;
C.氢氧化钡与硫酸铜反应生成硫酸钡和氢氧化铜沉淀,离子方程式为:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓;
故答案为:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓.
故答案为:Ba2++SO42-=BaSO4↓;
B.氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,离子方程式为:Cu2++2OH-═Cu(OH)2↓;
故答案为:Cu2++2OH-═Cu(OH)2↓;
C.氢氧化钡与硫酸铜反应生成硫酸钡和氢氧化铜沉淀,离子方程式为:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓;
故答案为:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓.
点评:本题考查了离子方程式的书写,明确反应的实质是解题关键,注意化学式的正确拆分,离子方程式应遵循质量守恒定律,电荷守恒定律等,题目难度不大.

练习册系列答案
相关题目
硫酸钾和硫酸铝的混合溶液,已知其中Al3+的浓度为0.4mol/L,硫酸根离子浓度为0.7mol/L,则K+的物质的量浓度为( )
| A、0.1 mol/L |
| B、0.15 mol/L |
| C、0.3 mol/L |
| D、0.2 mol/L |
下列各图均能表示甲烷的分子结构,哪一种更能反映其真实存在状况( ) 

| A、Ⅰ | B、Ⅱ | C、Ⅲ | D、Ⅳ |
能用H++OH-=H2O来表示的化学反应是( )
| A、氢氧化铜和稀盐酸反应 |
| B、氢氧化钡溶液滴入稀硫酸中 |
| C、氢氧化钠溶液与硝酸反应 |
| D、醋酸和氢氧化钾溶液 |
 化合物A是一种热稳定性较差的无水的弱酸钠盐.用如下方法对其进行分析:将A与惰性填料混合均匀制成样品,加热至400℃,记录含A量不同的样品的质量损失(%),结果列于下表:利用上述信息和下表中数据,通过作图,推断化合物A的化学式,并给出主要计算过程.
化合物A是一种热稳定性较差的无水的弱酸钠盐.用如下方法对其进行分析:将A与惰性填料混合均匀制成样品,加热至400℃,记录含A量不同的样品的质量损失(%),结果列于下表:利用上述信息和下表中数据,通过作图,推断化合物A的化学式,并给出主要计算过程.