题目内容
某浅绿色溶液A中加入用硝酸酸化的硝酸银酸性溶液,生成白色沉淀B和黄色溶液C,再向溶液C中加入足量的氨水生成红褐色沉淀D.
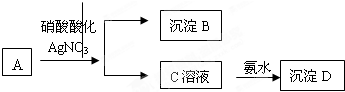
根据以上判断:
(1)A、B、C、D的化学式:A B C D
(2)写出C到D反应的离子方程式
(3)写出A和硝酸反应的化学方程式 .

根据以上判断:
(1)A、B、C、D的化学式:A
(2)写出C到D反应的离子方程式
(3)写出A和硝酸反应的化学方程式
考点:无机物的推断
专题:推断题
分析:某浅绿色溶液A中含有Fe2+,加入用硝酸酸化的硝酸银酸性溶液,生成白色沉淀B为AgCl,则A溶液为FeCl2,被硝酸氧化为黄色溶液C为FeCl3,再向溶液C中加入足量的氨水生成红褐色沉淀D为Fe(OH)3,依据分析判断回答问题.
解答:
解:某浅绿色溶液A中含有Fe2+,加入用硝酸酸化的硝酸银酸性溶液,生成白色沉淀B为AgCl,则A溶液为FeCl2,被硝酸氧化为黄色溶液C为FeCl3,再向溶液C中加入足量的氨水生成红褐色沉淀D为Fe(OH)3;
(1)上述分析可知A、B、C、D的化学式分别为:FeCl2,AgCl,FeCl3,Fe(OH)3 ;
故答案为:FeCl2,AgCl,FeCl3,Fe(OH)3 ;
(2)C到D反应为铁离子和一水合氨反应生成氢氧化铁沉淀和铵根离子,反应的离子方程式为:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;
故答案为:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;
(3)A和硝酸反应,氯化亚铁和硝酸反应生成氯化铁,硝酸铁,一氧化氮和水,反应的化学方程式为:3FeCl2+4HNO3=2FeCl3+Fe(NO3)3+NO↑+2H2O;
故答案为:3FeCl2+4HNO3=2FeCl3+Fe(NO3)3+NO↑+2H2O;
(1)上述分析可知A、B、C、D的化学式分别为:FeCl2,AgCl,FeCl3,Fe(OH)3 ;
故答案为:FeCl2,AgCl,FeCl3,Fe(OH)3 ;
(2)C到D反应为铁离子和一水合氨反应生成氢氧化铁沉淀和铵根离子,反应的离子方程式为:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;
故答案为:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;
(3)A和硝酸反应,氯化亚铁和硝酸反应生成氯化铁,硝酸铁,一氧化氮和水,反应的化学方程式为:3FeCl2+4HNO3=2FeCl3+Fe(NO3)3+NO↑+2H2O;
故答案为:3FeCl2+4HNO3=2FeCl3+Fe(NO3)3+NO↑+2H2O;
点评:本题考查了物质性质和转化关系的分析判断,主要是反应现象和物质性质的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各组离子因为生成难溶物而不能大量共存的是( )
| A、Cl-、Fe3+、NO3-、OH- |
| B、HCO3-、Cl-、Na+、H+ |
| C、Ba2+、Cl-、NO3-、K+ |
| D、NH4+、K+、OH-、Cl- |
用一定物质的量浓度的BaCl2溶液,使物质的量浓度相同的FeSO4溶液和Fe2(SO4)3溶液中的SO42-完全沉淀.如果所用的BaCl2溶液的体积比为1:2,则FeSO4和Fe2(SO4)3溶液的体积比为( )
| A、1:1 | B、1:3 |
| C、3:1 | D、3:2 |
以下实验原理或操作中,正确的是( )

| A、装置①量取15.00 mLNaOH溶液 |
| B、装置②既可用于乙醇制乙烯的发生装置,又可用于分离沸点相差较大的互溶液体混合物 |
| C、室温下,含有CoCl2的干燥变色硅胶呈蓝色,在潮湿的空气中变粉红色,放在干燥的空气中又恢复为蓝色 |
| D、纸层析法分离铁离子和铜离子实验中,展开剂的成份为蒸馏水与丙酮 |
分析下表中各项的排布规律,有机物X是按此规律排布的第19项,下列有关X的结构和性质说法中一定错误的是
( )
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
| A、是戊酸,同分异构体有4种 |
| B、是酯,在稀硫酸条件下水解的两种产物的相对分子质量不可能相等 |
| C、可以发生银镜反应 |
| D、可以与溴水发生加成反应 |
下列由相关实验现象所推出的结论正确的是( )
| A、向氯水中加入有色布条,片刻后有色布条褪色,说明有Cl2存在 |
| B、向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
| C、Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 |
| D、分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
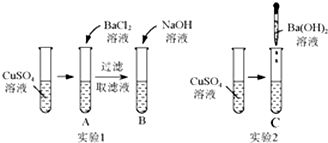 仔细分析如图中的实验:
仔细分析如图中的实验: