题目内容
 化合物A是一种热稳定性较差的无水的弱酸钠盐.用如下方法对其进行分析:将A与惰性填料混合均匀制成样品,加热至400℃,记录含A量不同的样品的质量损失(%),结果列于下表:利用上述信息和下表中数据,通过作图,推断化合物A的化学式,并给出主要计算过程.
化合物A是一种热稳定性较差的无水的弱酸钠盐.用如下方法对其进行分析:将A与惰性填料混合均匀制成样品,加热至400℃,记录含A量不同的样品的质量损失(%),结果列于下表:利用上述信息和下表中数据,通过作图,推断化合物A的化学式,并给出主要计算过程.| 样品中A的质量分数/% | 样品的质量损失/% |
| 20 | 7.4 |
| 50 | 18.5 |
| 70 | 25.8 |
| 90 | 33.3 |
考点:化学方程式的有关计算
专题:计算题
分析:通过表中的信息作出样品中A的质量分数和样品的质量损失的图象,然后根据图象分析解答,结合所学知识分析推理得出结论.
解答:
解:根据所给数据,作图如下: ,由图可见,样品的质量损失与其中 A 的质量分数呈线性关系;令样品中A的质量分数为x%,样品的质量损失y%,设直线为y=kx,当x=50%时,y=18.5,代入求出k=37,则直线方程为y=37x,当 A 的质量分数为 100%,即样品为纯 A,即x=1,代入方程,解得y=37,也就是其质量损失为 37.0%,样品是热稳定性较差的无水弱酸钠盐,在常见的弱酸盐中,首先考虑碳酸氢钠,其分解反应为:2NaHCO3=Na2CO3+H2O↑+CO2↑,该反应质量损失分数为
,由图可见,样品的质量损失与其中 A 的质量分数呈线性关系;令样品中A的质量分数为x%,样品的质量损失y%,设直线为y=kx,当x=50%时,y=18.5,代入求出k=37,则直线方程为y=37x,当 A 的质量分数为 100%,即样品为纯 A,即x=1,代入方程,解得y=37,也就是其质量损失为 37.0%,样品是热稳定性较差的无水弱酸钠盐,在常见的弱酸盐中,首先考虑碳酸氢钠,其分解反应为:2NaHCO3=Na2CO3+H2O↑+CO2↑,该反应质量损失分数为
×100%=36.9%,与上述外推所得数据吻合,化合物 A 的化学式是 NaHCO3,故答案为: ;NaHCO3;
;NaHCO3;
 ,由图可见,样品的质量损失与其中 A 的质量分数呈线性关系;令样品中A的质量分数为x%,样品的质量损失y%,设直线为y=kx,当x=50%时,y=18.5,代入求出k=37,则直线方程为y=37x,当 A 的质量分数为 100%,即样品为纯 A,即x=1,代入方程,解得y=37,也就是其质量损失为 37.0%,样品是热稳定性较差的无水弱酸钠盐,在常见的弱酸盐中,首先考虑碳酸氢钠,其分解反应为:2NaHCO3=Na2CO3+H2O↑+CO2↑,该反应质量损失分数为
,由图可见,样品的质量损失与其中 A 的质量分数呈线性关系;令样品中A的质量分数为x%,样品的质量损失y%,设直线为y=kx,当x=50%时,y=18.5,代入求出k=37,则直线方程为y=37x,当 A 的质量分数为 100%,即样品为纯 A,即x=1,代入方程,解得y=37,也就是其质量损失为 37.0%,样品是热稳定性较差的无水弱酸钠盐,在常见的弱酸盐中,首先考虑碳酸氢钠,其分解反应为:2NaHCO3=Na2CO3+H2O↑+CO2↑,该反应质量损失分数为| 44+18 |
| 2×84 |
 ;NaHCO3;
;NaHCO3;
点评:本题通过相关数据作图,然后根据图象的线性关系,得到纯净物质量损失,结合所学知识,得出结论,有一定的难度.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是( )


| A、原溶液中一定存在AlO2-、CO32-、SO42-、Cl-四种离子 |
B、气体A的化学式是CO2,其电子式为 |
| C、原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+ |
| D、生成沉淀B的离子方程式为:Al3++3OH-=Al(OH)3↓ |
下列关于胶体的叙述不正确的是( )
| A、利用丁达尔现象可以区别溶液和胶体 |
| B、胶体都可以发生丁达尔现象 |
| C、胶体粒子的大小都在1nm-100nm之间 |
| D、加热氢氧化铁胶体没有明显现象 |
想一想,如果将Ba(OH)2(固体)、CuSO4(固体)、纯醋酸(液态)归为一类,下列物质还可以和它们归为一类的是( )
| A、硝酸钠晶体 |
| B、豆浆 |
| C、Fe (OH)3胶体 |
| D、75%的酒精溶液 |
已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高,下列溶液沸点最高的是( )
| A、0.01 mol?L-1的蔗糖溶液 |
| B、0.01 mol?L-1的CaCl2溶液 |
| C、0.02 mol?L-1的NaCl溶液 |
| D、0.02 mol?L-1的氨水 |
下列各组离子因为生成难溶物而不能大量共存的是( )
| A、Cl-、Fe3+、NO3-、OH- |
| B、HCO3-、Cl-、Na+、H+ |
| C、Ba2+、Cl-、NO3-、K+ |
| D、NH4+、K+、OH-、Cl- |
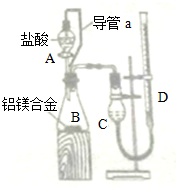
以下实验原理或操作中,正确的是( )
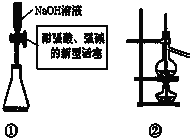

| A、装置①量取15.00 mLNaOH溶液 |
| B、装置②既可用于乙醇制乙烯的发生装置,又可用于分离沸点相差较大的互溶液体混合物 |
| C、室温下,含有CoCl2的干燥变色硅胶呈蓝色,在潮湿的空气中变粉红色,放在干燥的空气中又恢复为蓝色 |
| D、纸层析法分离铁离子和铜离子实验中,展开剂的成份为蒸馏水与丙酮 |
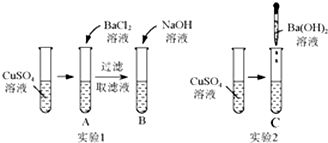 仔细分析如图中的实验:
仔细分析如图中的实验: