题目内容
14.在盛放浓硫酸的试剂瓶的标签上应印有下列警示标记中的( )| A. |  | B. |  | C. |  | D. |  |
分析 浓硫酸具有强腐蚀性,不能用手拿,以此来解答.
解答 解:浓硫酸具有强腐蚀性,不能用手拿,选择 作警示标记,而B中为剧毒标志、C中易燃标志、D中禁止标志,
作警示标记,而B中为剧毒标志、C中易燃标志、D中禁止标志,
故选A.
点评 本题考查浓硫酸的性质,为高频考点,把握物质的性质、化学品的标志为解答的关键,侧重分析与应用能力的考查,注意物质的性质及保存方法,题目难度不大.

练习册系列答案
相关题目
5.下列物质形成水溶液,溶液呈中性的是( )
| A. | CH3COONa | B. | NH4Cl | C. | KNO3 | D. | H2S |
9. 请完成下列问题
请完成下列问题
(1)已知红磷比白磷稳定,则反应
P4(白磷,s)+5O2(g)═2P2O5(s)△H1;
4P(红磷,s)+5O2(g)═2P2O5(s)△H2;
△H1和△H2的关系是△H1<△H2(填“>”、“<”)
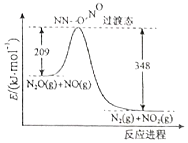
(2)由N2O和NO反应生成1mol N2和NO2的能量变化如图所示,请写出该反应的热化学方程式N2O(g)+NO(g)=N2(g)+NO2(g)△H=-139kJ•moL-1
(3)在298K、101kPa时,已知:
①2H2O(g)═O2(g)+2H2(g)△H1;
②Cl2(g)+H2(g)═2HCl(g)△H2;
③2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3,
则△H3与△H1和△H2之间的关系正确的是A.
A.△H3=△H1+2△H2B.△H3=△H1+△H2
C.△H3=△H1-2△H2D.△H3=△H1-△H2
(4)已知H2(g)+Br2(g)═2HBr(g)△H=-72kJ?mol-1,相关键能数据如表:
则表中a=354.
 请完成下列问题
请完成下列问题(1)已知红磷比白磷稳定,则反应
P4(白磷,s)+5O2(g)═2P2O5(s)△H1;
4P(红磷,s)+5O2(g)═2P2O5(s)△H2;
△H1和△H2的关系是△H1<△H2(填“>”、“<”)
(2)由N2O和NO反应生成1mol N2和NO2的能量变化如图所示,请写出该反应的热化学方程式N2O(g)+NO(g)=N2(g)+NO2(g)△H=-139kJ•moL-1
(3)在298K、101kPa时,已知:
①2H2O(g)═O2(g)+2H2(g)△H1;
②Cl2(g)+H2(g)═2HCl(g)△H2;
③2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3,
则△H3与△H1和△H2之间的关系正确的是A.
A.△H3=△H1+2△H2B.△H3=△H1+△H2
C.△H3=△H1-2△H2D.△H3=△H1-△H2
(4)已知H2(g)+Br2(g)═2HBr(g)△H=-72kJ?mol-1,相关键能数据如表:
| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
19.反应CO2(g)+2NH3(g)?CO(NH2)2(s)+H2O(g)△H<0,达到平衡时,下列说法正确的是( )
| A. | 加入催化剂,平衡常数不变 | |
| B. | 减小容器体积,正、逆反应速率均减小 | |
| C. | 保持容积不变,增大CO2的量,NH3的转化率减小 | |
| D. | 降低温度,平衡向逆反应方向移动 |
3.表格中各项分类都正确的一组是( )
| 类别 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 苏打 | 纯净空气 | CaCO3 | 干冰 |
| B | 碘酒 | 漂白粉 | NH3•H20 | Fe |
| C | 明矾 | 铝合金 | 石墨 | 醋酸 |
| D | 盐酸 | CuSO4•5H2O | Na2SO4 | 酒精 |
| A. | A | B. | B | C. | C | D. | D |

 某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、K+、OH-、NO3-、CO32-、SO42-.为了进一步确认,对该溶液进行实验检测:
某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、K+、OH-、NO3-、CO32-、SO42-.为了进一步确认,对该溶液进行实验检测: