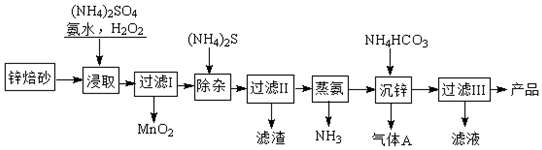
题目内容
9.下列各组能源中,前者是化石能源,后者是新能源的是( )| A. | 氢气、天然气 | B. | 液化气、核能 | C. | 太阳能、风能 | D. | 燃煤、97#汽油 |
分析 煤、石油、天然气等是化石能源,常见新能源有:太阳能、核能、地热能、潮汐能、风能等,据此进行解答.
解答 解:A.氢气和天然气分别为新能源和化石能源,故A错误;
B.液化气为化石能源,核能为新能源,满足条件,故B正确;
C.太阳能和风能都是新能源,故C错误;
D.煤和汽油都是化石能源,故D错误;
故选B.
点评 本题考查了能源的分类及判断,题目难度不大,明确常见能源的分类方法为解答关键,注意掌握化石能源与新能源的区别,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
3.用下列方法均可制得氧气:
(1)2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑
(2)2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑
(3)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑
若要制得相同质量的氧气,反应中电子转移数目之比为( )
(1)2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑
(2)2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑
(3)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑
若要制得相同质量的氧气,反应中电子转移数目之比为( )
| A. | 3:1:4 | B. | 2:1:1 | C. | 1:1:1 | D. | 1:2:2 |
18.同温同压下,已知O2的密度为ρg/L,则NH3的密度为( )
| A. | $\frac{32p}{17}$ g/L | B. | $\frac{17p}{32}$ g/L | C. | $\frac{32}{17p}$ g/L | D. | $\frac{17}{32p}$ g/L |
19.反应CO2(g)+2NH3(g)?CO(NH2)2(s)+H2O(g)△H<0,达到平衡时,下列说法正确的是( )
| A. | 加入催化剂,平衡常数不变 | |
| B. | 减小容器体积,正、逆反应速率均减小 | |
| C. | 保持容积不变,增大CO2的量,NH3的转化率减小 | |
| D. | 降低温度,平衡向逆反应方向移动 |

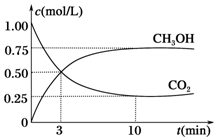 2009年10月15日新华社报道:全国农村应当在“绿色生态•美丽多彩•低碳节能•循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:
2009年10月15日新华社报道:全国农村应当在“绿色生态•美丽多彩•低碳节能•循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题: