题目内容
11.NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 一定条件下,将1mol N2和3mol H2混合发生反应,转移的电子总数为6NA | |
| B. | 30g SiO2中含有的硅氧键数为NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有2mol Fe2+被氧化时,消耗Cl2的分子数为NA | |
| D. | 取50 mL 14.0 mol•L-1 浓硝酸与足量的铜片反应,生成气体分子的数目可能为0.25NA |
分析 A、合成氨的反应为可逆反应;
B、求出二氧化硅的物质的量,然后根据二氧化硅中含4条硅氧键来分析;
C、碘离子的还原性强于 Fe2+的还原性;
D、取50mL 14.0moI/L浓硝酸与足量的铜片反应,开始生成的是NO2,随着硝酸变稀,生成的气体为NO、N2等.
解答 解:A、合成氨的反应为可逆反应,不能进行彻底,则转移的电子数小于6NA个,故A错误;
B、30g二氧化硅的物质的量为0.5mol,而二氧化硅中含4条硅氧键,故0.5mol二氧化硅中含2NA个,故B错误;
C、碘离子的还原性强于 Fe2+的还原性,故当有2mol Fe2+被氧化时,碘离子全部被氧化,故消耗Cl2的分子数大于NA,故C错误;
D、取50mL 14.0moI/L浓硝酸与足量的铜片反应,开始生成的是NO2,随着硝酸变稀,生成的气体为NO、N2等,故生成的气体分子个数小于0.35NA个,故可能为0.25NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目
1.已知乙醛(CH3CHO)和新制氢氧化铜的反应如下:CH3CHO+2Cu(OH)2+NaOH $\stackrel{△}{→}$ CH3COONa+Cu2O↓+3H2O某实验小组做上述反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5mL 40%的乙醛溶液进行下列实验.
(1)上表中a、b应为B(填字母序号).
A.15滴,1mL B.2mL,1mL C.15滴,2mL D.2mL,2mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解.写出生成Cu2(OH)2SO4反应的化学方程式2NaOH+2CuSO4═Cu2(OH)2SO4↓+Na2SO4.基于实验1、2的现象可以得出结论:NaOH用量较少时,乙醛未参与氧化反应,(或是含铜元素的化合物在发生变化).
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是依据现象提出依据:实验2中的黑色沉淀可能是CuO;实验4中的红色沉淀可能是Cu2O,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
依据理论提出依据:当NaOH用量逐渐增多时,产生的Cu(OH)2一部分受热分解生成黑色的CuO;另一部分被乙醛还原为Cu2O红色沉淀,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu.并进行了以下实验.
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液.
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是溶液变为蓝色,有红色固体.
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是将1mL2%CuSO4溶液与3mL(或>3mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5mL40%的乙醛溶液,水浴加热.基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10.
| 编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
| 1 | 2mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
| 2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
| 3 | 1mL | 1mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
| 4 | b | 2mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
| 5 | 1mL | 3mL | 蓝紫色溶液 | 12~13 | ---- |
A.15滴,1mL B.2mL,1mL C.15滴,2mL D.2mL,2mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解.写出生成Cu2(OH)2SO4反应的化学方程式2NaOH+2CuSO4═Cu2(OH)2SO4↓+Na2SO4.基于实验1、2的现象可以得出结论:NaOH用量较少时,乙醛未参与氧化反应,(或是含铜元素的化合物在发生变化).
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是依据现象提出依据:实验2中的黑色沉淀可能是CuO;实验4中的红色沉淀可能是Cu2O,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
依据理论提出依据:当NaOH用量逐渐增多时,产生的Cu(OH)2一部分受热分解生成黑色的CuO;另一部分被乙醛还原为Cu2O红色沉淀,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu.并进行了以下实验.
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液.
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是溶液变为蓝色,有红色固体.
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是将1mL2%CuSO4溶液与3mL(或>3mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5mL40%的乙醛溶液,水浴加热.基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10.
2.25℃,c(HCN)+c(CN-)=0.1mol•L-1的一组HCN和NaCN的混合溶液,溶液中c (HCN)、c(CN-)与pH的关系如图所示.下列有关离子浓度关系叙述正确的是( )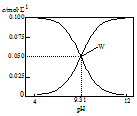

| A. | 将0.1 mol•L-1的HCN溶液和0.1 mol•L-1NaCN溶液等体积混合(忽略溶液体积变化):c(Na+)>c(HCN)>c(CN-)>c(OH-)>c(H+) | |
| B. | W点表示溶液中:c(Na+)+c(H+)=c(HCN) | |
| C. | pH=8的溶液中:c(Na+)+c(H+)+c(HCN)=0.1mol•L-1+c(OH-) | |
| D. | 将0.3 mol•L-1HCN溶液和0.2 mol•L-1NaOH溶液等体积混合(忽略溶液体积变化):c(CN-)+3c(OH-)=2c(HCN)+3c(H+) |
19.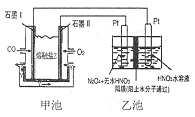 现以CO、O2、熔熔盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法错误的是( )
现以CO、O2、熔熔盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法错误的是( )
 现以CO、O2、熔熔盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法错误的是( )
现以CO、O2、熔熔盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法错误的是( )| A. | 石墨I是原电池的负极,发生氧化反应 | |
| B. | 甲池中的CO32-向石墨I极移动 | |
| C. | 乙池中左端Pt极电极反应式:N2O4-2e-+2HNO3=2N2O5+2H+ | |
| D. | 若甲池消耗标准状况下的氧气2.24L,则乙池中产生氢气0.05mol |
6.化学与杜会、生活密切相关.对下列现象或事实的解释错误的是( )
| 选项 | 现象或事实 | 解释 |
| A | 用浸有酸性高锰酸钾溶液的硅藻土作水果保鲜剂 | 酸性高锰酸钾溶液能氧化水果释放的乙烯 |
| B | 高温能杀死流感病毒 | 病毒的蛋白质受热变性 |
| C | 用过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | 用Al(OH)3用作塑料的阻燃剂 | A(OH)3分解会吸收热量且产物不能燃烧 |
| A. | A | B. | B | C. | C | D. | D |
16.仅用提供的硅酸盐仪器(非硅酸盐仪器任选),不能达到相应实验目的是( )
| A. | 提纯粗盐:烧杯、玻璃棒、酒精灯、蒸发皿、漏斗 | |
| B. | 中和热的测定:量筒、温度计、环形玻璃搅拌棒、胶头滴管 | |
| C. | 用CCl4提取碘水中的碘:分液漏斗、烧杯 | |
| D. | 用18.4 mol•L-1浓硫酸配制100mL 1.0 mol•L-1硫酸:10mL量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管 |
3.有关X、Y、Z、W四种短周期元素性质的数据如表:
下列有关叙述中错误的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 66 | 70 | 143 | 160 |
| 主要化合价 | -2 | +5、+3、-3 | +3 | +2 |
| A. | X和Y能形成多种共价化合物 | |
| B. | 最简单氢化物的沸点:X>Y | |
| C. | 工业上常用电解Z的氯化物水溶液的方法制备Z单质 | |
| D. | Z和W的氧化物均能溶于Y的最高价氧化物对应的水化物溶液中 |
20.设NA为阿伏加罗常数的值,下列说法正确的是( )
| A. | 1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA | |
| B. | 室温时,1.0L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| C. | Fe与水蒸汽反应生成22.4L氢气,转移电子数为2NA | |
| D. | 14g分子式为C3H6的链烃中含有的C-H键的数目为2NA |
15.下列实验操作能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和的FeCl3溶液中 |
| B | 区分碳酸钠和碳酸氢钠两种溶液 | 用氢氧化钡溶液分别滴加,观察现象 |
| C | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
| D | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
| A. | A | B. | B | C. | C | D. | D |