题目内容
8.关于小苏打溶液的表述错误的是( )| A. | c(Na+)═c(HCO3-)+c(CO32-)+c(H2CO3) | B. | c(Na+)+c(H+)═c(HCO3-)+2c(CO32-)+c(OH-) | ||
| C. | HCO3-的电离程度小于其水解程度 | D. | c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) |
分析 A.根据碳酸氢钠溶液中的物料守恒分析;
B.根据碳酸氢钠溶液中的电荷守恒判断;
C.碳酸氢钠溶液呈碱性,说明碳酸氢根离子的水解程度大于其电离程度;
D.氢离子来自碳酸氢根离子和水的电离,则c(H+)>c(CO32-).
解答 解:A.碳酸氢钠溶液中存在物料守恒:c(Na+)═c(HCO3-)+c(CO32-)+c(H2CO3),故A正确;
B.根据碳酸氢钠溶液中的电荷守恒可知:c(Na+)+c(H+)═c(HCO3-)+2c(CO32-)+c(OH-),故B正确;
C.碳酸氢钠溶液呈碱性,则HCO3-的电离程度小于其水解程度,故C正确;
D.HCO3-的水解程度大于其电离程度,溶液呈碱性,则c(OH-)>c(H+),氢离子来自碳酸氢根离子和水的电离,则c(H+)>c(CO32-),正确的离子浓度大小为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),故D错误;
故选D.
点评 本题考查离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理的含义为解答关键,注意掌握比较离子浓度大小比较的方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
18.下列有关物质的性质或结构的说法中正确的是( )
| A. | L层上的电子数为奇数的原子不一定是主族元素的原子 | |
| B. | 只由共价键形成的物质不一定是共价化合物 | |
| C. | 化学键的形成一定伴随着电子的转移和能量变化 | |
| D. | 元素周期表中,位于金属和非金属分界线附近的元素属于过渡元素 |
19.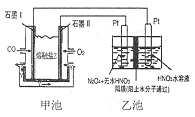 现以CO、O2、熔熔盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法错误的是( )
现以CO、O2、熔熔盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法错误的是( )
 现以CO、O2、熔熔盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法错误的是( )
现以CO、O2、熔熔盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法错误的是( )| A. | 石墨I是原电池的负极,发生氧化反应 | |
| B. | 甲池中的CO32-向石墨I极移动 | |
| C. | 乙池中左端Pt极电极反应式:N2O4-2e-+2HNO3=2N2O5+2H+ | |
| D. | 若甲池消耗标准状况下的氧气2.24L,则乙池中产生氢气0.05mol |
16.仅用提供的硅酸盐仪器(非硅酸盐仪器任选),不能达到相应实验目的是( )
| A. | 提纯粗盐:烧杯、玻璃棒、酒精灯、蒸发皿、漏斗 | |
| B. | 中和热的测定:量筒、温度计、环形玻璃搅拌棒、胶头滴管 | |
| C. | 用CCl4提取碘水中的碘:分液漏斗、烧杯 | |
| D. | 用18.4 mol•L-1浓硫酸配制100mL 1.0 mol•L-1硫酸:10mL量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管 |
3.有关X、Y、Z、W四种短周期元素性质的数据如表:
下列有关叙述中错误的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 66 | 70 | 143 | 160 |
| 主要化合价 | -2 | +5、+3、-3 | +3 | +2 |
| A. | X和Y能形成多种共价化合物 | |
| B. | 最简单氢化物的沸点:X>Y | |
| C. | 工业上常用电解Z的氯化物水溶液的方法制备Z单质 | |
| D. | Z和W的氧化物均能溶于Y的最高价氧化物对应的水化物溶液中 |
13.化学在生活中有着广泛的应用,下列物质性质与应用对应关系错误的是( )
| A. | 硅胶吸水能力强,可作食品干燥剂 | |
| B. | CaO能与SO2反应,可作工业废气脱硫剂 | |
| C. | 聚四氟乙烯耐高温、耐腐蚀、不粘附、无毒害,可用于厨具表面涂层 | |
| D. | Na2S具有还原性,可作废水中Cu2+和Hg2+的沉淀剂 |
20.设NA为阿伏加罗常数的值,下列说法正确的是( )
| A. | 1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA | |
| B. | 室温时,1.0L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| C. | Fe与水蒸汽反应生成22.4L氢气,转移电子数为2NA | |
| D. | 14g分子式为C3H6的链烃中含有的C-H键的数目为2NA |