题目内容
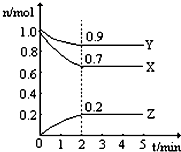 某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线,如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线,如图所示.根据图中数据,试填写下列空白:(1)该反应的化学方程式为
(2)反应开始至2min,气体Z的平均反应速率为
(3)反应达平衡时,X的转化率为
(4)下列能标志反应达到平衡状态的是
A.各组分物质的量不变
B.气体总质量不变
C.气体压强不变D.气体密度不变
E.气体平均分子量不变.
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)根据曲线的变化趋势判断反应物和生成物,根据物质的量变化之比等于化学计量数之比书写方程式;
(2)根据2min内Z物质的量变化量和容器体积,可知道浓度变化量,通过计算可知用气体Z表示的反应速率;
(3)反应达平衡时,X的转化率为已转化的物质的量与起始物质的量的比值;体的压强之比等于气体的物质的量之比,可求出开始时气体的总物质的量和平衡后气体总物质的量,得到答案;
(4)根据化学平衡状态特征判断.
(2)根据2min内Z物质的量变化量和容器体积,可知道浓度变化量,通过计算可知用气体Z表示的反应速率;
(3)反应达平衡时,X的转化率为已转化的物质的量与起始物质的量的比值;体的压强之比等于气体的物质的量之比,可求出开始时气体的总物质的量和平衡后气体总物质的量,得到答案;
(4)根据化学平衡状态特征判断.
解答:
解:(1)△n(X)=0.3mol;△n(Y)=0.1mol;△n(Z)=0.2mol,所以三者计量数之比为3:1:2,故答案为:3X+Y?2Z;
(2)v(Z)=
=
=0.05mol?L-1?min-1,故答案为:0.05mol?L-1?min-1;
(3)X转化的物质的量为1.0mol-0.7mol=0.3mol,转化率为
×100%=30%;根据图象中可知,开始时气体总物质的量为:2mol;平衡后气体总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol;压强之比等于物质的量之比,即压强之比为
=
,故答案:30%;9:10;
(4)A.各组分物质的量不变,达到化学平衡状态,故A正确;
B.气体质量始终不变,不能判断是否平衡,故B错误;
C.反应前后气体物质的量不同,当压强不变时,气体的物质的量不变,达到化学平衡状态,故C正确;
D.ρ=
,气体质量不变,容器体积不变,密度始终不变,不能判断是否平衡,故D错误;
E.M=
,气体质量不变,反应前后气体物质的量不同,平均相对分子质量不变时,达到平衡状态,故E正确;
故选ACE.
(2)v(Z)=
| △c |
| △t |
| 0.2mol |
| 2L×2min |
(3)X转化的物质的量为1.0mol-0.7mol=0.3mol,转化率为
| 0.3mol |
| 1.0mol |
| 1.8mol |
| 2mol |
| 9 |
| 10 |
(4)A.各组分物质的量不变,达到化学平衡状态,故A正确;
B.气体质量始终不变,不能判断是否平衡,故B错误;
C.反应前后气体物质的量不同,当压强不变时,气体的物质的量不变,达到化学平衡状态,故C正确;
D.ρ=
| m |
| V |
E.M=
| m |
| n |
故选ACE.
点评:该题通过图象中物质的物质的量的变化,来考查化学平衡的移动、化学反应速率计算、化学平衡状态的判断,综合考查学生对知识的综合应用能力.

练习册系列答案
相关题目
下列有关化学反应的说法正确的是( )
| A、在氧化还原反应中,阴离子只能发生氧化反应 |
| B、碳酸钠溶液显碱性,碳酸钠是一种碱 |
| C、有些吸热反应不需要加热也能进行 |
| D、1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
 废铁屑(含铁锈)可用于地下水脱氮,某课题小组模拟地下水脱氮过程,并研究脱氮原理及脱氮效果.
废铁屑(含铁锈)可用于地下水脱氮,某课题小组模拟地下水脱氮过程,并研究脱氮原理及脱氮效果. 理论上任何自发的氧化还原反应都可以设计成原电池.如使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池.
理论上任何自发的氧化还原反应都可以设计成原电池.如使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池.
 (1)在容积为VL的密闭容器中发生反应:2NO2?2NO+O2.反应过程中NO2的物质的量随时间变化的情况如图所示.
(1)在容积为VL的密闭容器中发生反应:2NO2?2NO+O2.反应过程中NO2的物质的量随时间变化的情况如图所示.