题目内容
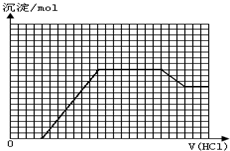 某无色溶液M可能含有离子OH-、HCO3-、CO32-、SO42-、SiO32-、AlO2-、NH4+、MnO4-、Cu2+、Mg2+、Na+、Fe3+中的若干种.取一定量的M溶液滴加盐酸,产生沉淀的物质的量与盐酸体积的关系如图所示.下列判断正确的是( )
某无色溶液M可能含有离子OH-、HCO3-、CO32-、SO42-、SiO32-、AlO2-、NH4+、MnO4-、Cu2+、Mg2+、Na+、Fe3+中的若干种.取一定量的M溶液滴加盐酸,产生沉淀的物质的量与盐酸体积的关系如图所示.下列判断正确的是( )| A、原溶液中可能含有NH4+、SO42- |
| B、最终溶液中最少含2种溶质 |
| C、原溶液中n(NaAlO2):n(Na2CO3)=1:1 |
| D、滴加盐酸初始阶段发生反应的离子方程式是:CO32-+H+=HCO3- |
考点:离子共存问题,离子方程式的有关计算
专题:图示题,离子反应专题
分析:无色溶液中不存在有色离子:MnO4-、Cu2+、Fe3+;加入盐酸时,开始没有生成沉淀,说明溶液中一定存在氢氧根离子,所以一定不存在碳酸氢根离子;之后开始生成沉淀,沉淀达到最大量后沉淀的量暂时不变,最后沉淀随着盐酸的加入,沉淀逐渐减少,直至沉淀的物质的量不再变化,说明该沉淀为氢氧化铝和硅酸的混合物,说明溶液中一定存在SiO32-、AlO2-、CO32-,则一定不存在NH4+、Mg2+,根据以上分析并结合图象数据进行解答.
解答:
解:根据溶液为无色可知,溶液中一定不存在MnO4-、Cu2+、Fe3+;初始加入盐酸时没有生成沉淀,说明溶液中一定存OH-、HCO3-离子,所以一定不存在HCO3-;之后开始生成沉淀,当沉淀达到最大量后沉淀的量暂时不变,最后沉淀随着盐酸的加入,沉淀逐渐减少,直至沉淀的物质的量不再变化,说明该沉淀为氢氧化铝和硅酸的混合物,说明溶液中一定存在SiO32-、AlO2-、CO32-,则一定不存在NH4+、Mg2+,
A.根据以上分析可知,溶液中一定不存在NH4+,故A错误;
B.最终溶液中最少含氯化钠和氯化铝两种溶质,故B正确;
C.设单位体积中含有氯化氢nmol,根据图象可知,溶解氢氧化铝消耗氯化氢的物质的量为3nmol,则含有氢氧化铝nmol,根据铝原子守恒,原溶液中含有nmol偏铝酸钠;碳酸钠消耗氯化氢的物质的量为8nmol,则溶液中含有碳酸钠的物质的量为4nmol,原溶液中n(NaAlO2):n(Na2CO3)=4:1,故C错误;
D.滴加盐酸初始阶段,参加反应的离子为氢氧根离子,反应的离子方程式为:OH-+H+=H2O,故D错误;
A.根据以上分析可知,溶液中一定不存在NH4+,故A错误;
B.最终溶液中最少含氯化钠和氯化铝两种溶质,故B正确;
C.设单位体积中含有氯化氢nmol,根据图象可知,溶解氢氧化铝消耗氯化氢的物质的量为3nmol,则含有氢氧化铝nmol,根据铝原子守恒,原溶液中含有nmol偏铝酸钠;碳酸钠消耗氯化氢的物质的量为8nmol,则溶液中含有碳酸钠的物质的量为4nmol,原溶液中n(NaAlO2):n(Na2CO3)=4:1,故C错误;
D.滴加盐酸初始阶段,参加反应的离子为氢氧根离子,反应的离子方程式为:OH-+H+=H2O,故D错误;
点评:本题考查离子共存的正误判断、有关离子反应的计算,题目难度稍大,注意掌握离子反应发生条件,正确分析图象信息是解答本题的关键,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
下列举措不符合“节能减排”要求的是( )
| A、在西部和沿海地区兴建风力发电站,解决能源问题 |
| B、推广与发展小排量汽车和电动、混合动力汽车 |
| C、大力开发丰富的煤炭资源,减少对石油的依赖 |
| D、回收废弃饮料包装纸,制作成公园内的休闲长椅 |
2012年4月,卫生部在官网发布了拟撤销2,4-二氯苯氧乙酸等38种食品添加剂意见函,并公开征求意见.下列有关食品添加剂的说法正确的是( )
| A、需要长时间储存的食品应加入适宜的防腐剂 |
| B、冰激凌不使用着色剂营养价值一定会降低 |
| C、炒菜时拒绝添加食盐、味精等各种调味剂 |
| D、色、香、味俱全的食物营养价值不一定高 |
下列各个装置中能组成原电池的是( )
A、 稀硫酸 |
B、 CuSO4溶液 |
C、 酒精溶液 |
D、 |
 Ⅰ、(将2mol SO2和1mol O2气体在1L的容器中混合,在一定条件下发生如下反应:2SO2(g)+O2 (g) 2SO3 (g).若经过2s后测得SO3的浓度为0.6mol/L.试计算:(1)O2的化学反应速率V(O2)=
Ⅰ、(将2mol SO2和1mol O2气体在1L的容器中混合,在一定条件下发生如下反应:2SO2(g)+O2 (g) 2SO3 (g).若经过2s后测得SO3的浓度为0.6mol/L.试计算:(1)O2的化学反应速率V(O2)=
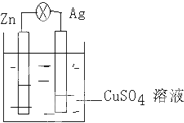 在银锌原电池中,以硫酸铜为电解质溶液,
在银锌原电池中,以硫酸铜为电解质溶液,