题目内容
在第三周期中:①置换酸中氢的能力最强的单质为 ,②化学性质最稳定的单质的化学式为 ,③酸性最强的最高价氧化物的水化物是 ,④显两性的氢氧化物的化学式是 ,⑤第④中的化合物与盐酸、氢氧化钠溶液分别反应的离子方程式为: 、 ,⑥原子半径最大的非金属元素的名称是 ,⑦半径最小的金属阳离子的离子结构示意图是 .
考点:同一周期内元素性质的递变规律与原子结构的关系
专题:元素周期律与元素周期表专题
分析:同周期从左到右置换氢的能力逐渐减弱;同周期稀有气体最稳定;同周期从左到右最高价氧化物的水化物的酸性逐渐增强、最高价氧化物的水化物的碱性逐渐减弱;
同周期从左到右原子半径逐渐减小,阳离子比较逐渐减小,据此分析.
同周期从左到右原子半径逐渐减小,阳离子比较逐渐减小,据此分析.
解答:
解:①同周期从左到右置换氢的能力逐渐减弱,所以在第三周期中置换酸中氢的能力最强的单质为Na;
故答案为:Na;
②同周期稀有气体最稳定,则第三周期化学性质最稳定的单质的化学式为Ar;
故答案为:Ar;
③同周期从左到右最高价氧化物的水化物的酸性逐渐增强,则第三周期酸性最强的最高价氧化物的水化物是HClO4;
故答案为:HClO4;
④同周期从左到右最高价氧化物的水化物的碱性逐渐减弱,则第三周期显两性的氢氧化物是Al(OH)3,故答案为:Al(OH)3;
⑤Al(OH)3与强酸、强碱均反应,其反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,Al(OH)3+OH-=AlO2-+2H2O;
故答案为:Al(OH)3+3H+=Al3++3H2O;Al(OH)3+OH-=AlO2-+2H2O;
⑥同周期从左到右原子半径逐渐减小,原子半径最大的非金属元素的名称是硅,故答案为:硅;
⑦同周期从左到右阳离子比较逐渐减小,半径最小的金属阳离子为Al3+,其离子结构示意图是 ;故答案为:
;故答案为: .
.
故答案为:Na;
②同周期稀有气体最稳定,则第三周期化学性质最稳定的单质的化学式为Ar;
故答案为:Ar;
③同周期从左到右最高价氧化物的水化物的酸性逐渐增强,则第三周期酸性最强的最高价氧化物的水化物是HClO4;
故答案为:HClO4;
④同周期从左到右最高价氧化物的水化物的碱性逐渐减弱,则第三周期显两性的氢氧化物是Al(OH)3,故答案为:Al(OH)3;
⑤Al(OH)3与强酸、强碱均反应,其反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,Al(OH)3+OH-=AlO2-+2H2O;
故答案为:Al(OH)3+3H+=Al3++3H2O;Al(OH)3+OH-=AlO2-+2H2O;
⑥同周期从左到右原子半径逐渐减小,原子半径最大的非金属元素的名称是硅,故答案为:硅;
⑦同周期从左到右阳离子比较逐渐减小,半径最小的金属阳离子为Al3+,其离子结构示意图是
 ;故答案为:
;故答案为: .
.
点评:本题考查了元素周期律,明确同周期元素性质的递变规律是解决本题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
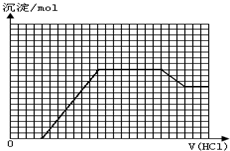 某无色溶液M可能含有离子OH-、HCO3-、CO32-、SO42-、SiO32-、AlO2-、NH4+、MnO4-、Cu2+、Mg2+、Na+、Fe3+中的若干种.取一定量的M溶液滴加盐酸,产生沉淀的物质的量与盐酸体积的关系如图所示.下列判断正确的是( )
某无色溶液M可能含有离子OH-、HCO3-、CO32-、SO42-、SiO32-、AlO2-、NH4+、MnO4-、Cu2+、Mg2+、Na+、Fe3+中的若干种.取一定量的M溶液滴加盐酸,产生沉淀的物质的量与盐酸体积的关系如图所示.下列判断正确的是( )| A、原溶液中可能含有NH4+、SO42- |
| B、最终溶液中最少含2种溶质 |
| C、原溶液中n(NaAlO2):n(Na2CO3)=1:1 |
| D、滴加盐酸初始阶段发生反应的离子方程式是:CO32-+H+=HCO3- |
鉴别溶液与胶体最简单的方法是( )
| A、丁达尔效应 | B、过滤 |
| C、布朗运动 | D、透过半透膜 |
下列有关碱金属铷(Rb)的叙述中,正确的是( )
| A、铷与水反应的现象与钠相似 |
| B、碳酸铷不溶于水 |
| C、在钠、钾、铷三种单质中,铷的熔点最低 |
| D、氢氧化铷是弱碱 |
 (1)已知在一定条件下的反应4HCl+O2=2Cl2+2H2O中,有4mol HCl被氧化时,放出
(1)已知在一定条件下的反应4HCl+O2=2Cl2+2H2O中,有4mol HCl被氧化时,放出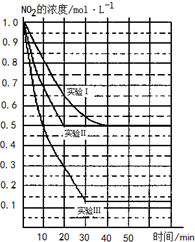 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为1.0mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.请回答下列问题:
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为1.0mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.请回答下列问题: