题目内容
可逆反应2A(g)?B(g)(放热反应)从反应开始至建立平衡后改变某一外界条件(外界条件指的是温度、压强、浓度和催化剂)使平衡发生了移动至新的平衡,该过程中各物质的浓度(用c表示)随时间变化情况如下图所示,试分析各图,指出导致平衡移动的因素和平衡移动的方向:
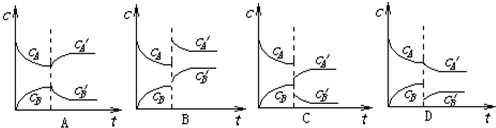

| 序号 | 平衡移动的因素 | 平衡移动的方向(填“逆反应方向”或“正反应方向”) |
| A | ||
| B | ||
| C | ||
| D |
考点:化学反应速率与化学平衡图象的综合应用
专题:化学平衡专题
分析:已知可逆反应2A(g)?B(g)△H<0,该反应正方向为放热的、体积减小的反应,根据温度及压强对平衡的影响分析.
解答:
解:已知可逆反应2A(g)?B(g)△H<0,该反应正方向为放热的、体积减小的反应;
A、图象A中改变条件后,反应物A的浓度增大,生成物B的浓度减小,则平衡逆向移动,AB的浓度是逐渐增大的,所以改变的条件不是浓度或压强,则改变的条件是升高温度;
B、图象B中改变条件后,A、B的浓度都突然增大,则改变的条件是缩小体积,即增大了压强,平衡正反应方向移动;
C、图象C中改变条件后,A、B的浓度都突然减小,则改变的条件是扩大体积,即减小了压强,减小压强平衡向体积增大的方向进行,即逆向进行;
D、图象D中改变条件后,A、B的浓度都减小,B的浓度突然减小,所以图示曲线是减小生成物B的浓度,平衡向正反应方向进行,故答案为:
.
A、图象A中改变条件后,反应物A的浓度增大,生成物B的浓度减小,则平衡逆向移动,AB的浓度是逐渐增大的,所以改变的条件不是浓度或压强,则改变的条件是升高温度;
B、图象B中改变条件后,A、B的浓度都突然增大,则改变的条件是缩小体积,即增大了压强,平衡正反应方向移动;
C、图象C中改变条件后,A、B的浓度都突然减小,则改变的条件是扩大体积,即减小了压强,减小压强平衡向体积增大的方向进行,即逆向进行;
D、图象D中改变条件后,A、B的浓度都减小,B的浓度突然减小,所以图示曲线是减小生成物B的浓度,平衡向正反应方向进行,故答案为:
| 序号 | 平衡移动的因素 | 平衡移动的方向 |
| A | 升高温度 | 逆反应方向 |
| B | 增大压强 | 正反应方向 |
| C | 减小压强 | 逆反应方向 |
| D | 减小生成物B的浓度 | 正反应方向 |
点评:本题考查了化学平衡图象,注意准确把握温度、压强对平衡的影响是解决本题的关键,题目难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
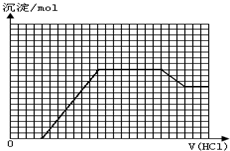 某无色溶液M可能含有离子OH-、HCO3-、CO32-、SO42-、SiO32-、AlO2-、NH4+、MnO4-、Cu2+、Mg2+、Na+、Fe3+中的若干种.取一定量的M溶液滴加盐酸,产生沉淀的物质的量与盐酸体积的关系如图所示.下列判断正确的是( )
某无色溶液M可能含有离子OH-、HCO3-、CO32-、SO42-、SiO32-、AlO2-、NH4+、MnO4-、Cu2+、Mg2+、Na+、Fe3+中的若干种.取一定量的M溶液滴加盐酸,产生沉淀的物质的量与盐酸体积的关系如图所示.下列判断正确的是( )| A、原溶液中可能含有NH4+、SO42- |
| B、最终溶液中最少含2种溶质 |
| C、原溶液中n(NaAlO2):n(Na2CO3)=1:1 |
| D、滴加盐酸初始阶段发生反应的离子方程式是:CO32-+H+=HCO3- |
关于氢键,下列说法正确的是( )
| A、DNA中的碱基互补配对是通过氢键来实现的 |
| B、氢键比分子间作用力强,所以它属于化学键 |
| C、含氢元素的化合物中一定有氢键 |
| D、H2O是一种非常稳定的化合物,这是由于氢键所致 |
 纯钛烤瓷牙是近几年才发展成熟的金属烤瓷技术,过氧硫酸被用于假牙的消毒.过氧硫酸可由氯磺酸通过反应I制得,氯磺酸结构如图1.
纯钛烤瓷牙是近几年才发展成熟的金属烤瓷技术,过氧硫酸被用于假牙的消毒.过氧硫酸可由氯磺酸通过反应I制得,氯磺酸结构如图1.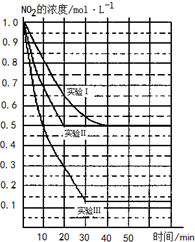 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为1.0mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.请回答下列问题:
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为1.0mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.请回答下列问题: