题目内容
13.硝酸与金属反应往往产生氮氧化物,但是在某些特殊情况则不然.将稀硝酸(HNO3浓度低于2mol•L一1)与过量金属镁缓和反应放出一种无色无毒气体A,反应完全后向剩余溶液中加人过量NaOH固体并加热,放出气体B,将两次放出气体全部收集并混合,用碱石灰干燥后缓慢通过足量的灼热氧化铜固体,观察到固体变红,将剩余气体用浓硫酸干燥,最后气体体积变为原来的四分之三,则下列分析正确的是(本题中所有气体体积均为相同条件下测得的体积)( )| A. | 无色无毒气体A为H2 | |
| B. | 最后气体为NH3 | |
| C. | 在镁与硝酸反应过程中还原剂与氧化剂的物质的量之比为5:1 | |
| D. | 气体A与气体B的体积比为1:1 |
分析 反应完全后向剩余溶液中加入过量NaOH固体并加热,放出气体B,应为氨气,将两次放出气体全部收集并混合,用碱石灰干燥后缓慢通过足量的灼热氧化铜固体,观察到固体变红,说明气体具有还原性,将剩余气体用浓硫酸干燥,气体体积变为原来的三分之一,灼热氧化铜变红过程发生的反应有2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3H2O+3Cu,说明含有氢气生成,则在原A、B混合气体中氨气占三分之二,气体A与气体B的体积之比为1:2,可写出反应的离子方程式,结合方程式解答该题.
解答 解:反应完全后向剩余溶液中加入过量NaOH固体并加热,放出气体B,应为氨气,将两次放出气体全部收集并混合,用碱石灰干燥后缓慢通过足量的灼热氧化铜固体,观察到固体变红,因2NH3+3Cu$\frac{\underline{\;\;△\;\;}}{\;}$N2+3H2O+3Cu,气体体积只减少一半,所以气体A能与氧化铜反应且气体体积减少的氢气,因为气体体积变为原来的三分之一,则在原A、B混合气体中氨气占三分之二,气体A与气体B的体积之比为1:2,由上可知镁与稀硝酸的反应的离子方程式为9Mg+22H++2NO3-=2NH4++H2↑+9Mg2++6H2O,最后生成气体是氢气,只有A正确,
故选A.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析、计算能力的考查,注意把握物质的性质以及生成气体的推断,把握体积的变化,最终能写出反应的离子放出为解答该题的关键,难度中等.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
3.体育比赛使用的发令枪中所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾.撞击时发生的化学反应方程式为:5KClO3+6P=3P2O5+5KCl,则下列有关叙述错误的是( )
| A. | 上述反应中氧化剂和还原剂的物质的量之比为5:6 | |
| B. | 产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成酸滴(雾) | |
| C. | 上述反应中消耗3molP时,转移电子的物质的量为15mol | |
| D. | 产物P2O5为酸性氧化物,但不是磷酸的酸酐 |
4.下列有关物质用途的说法中,不正确的是( )
| A. | NH3常用作制冷剂 | B. | 烧碱:治疗胃酸过多的一种药剂 | ||
| C. | Na2SiO3常用作制木材防火剂 | D. | NaHCO3常用作面粉发泡剂 |
1.在给定的条件下,下列物质间的转化均能实现的是( )
| A. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{NaOH溶液}{→}$NaNO3 | |
| B. | Fe2O3$→_{高温}^{Al}$Fe$→_{点燃}^{Cl_{2}}$FeCl3 | |
| C. | SiO2$→_{△}^{H_{2}O}$H2SiO3$\stackrel{NaOH溶液}{→}$NaSiO3 | |
| D. | NaSO4溶液$\stackrel{BaCl_{2}溶液}{→}$BaSO4$\stackrel{盐酸}{→}$BaCl2 |
8.下列试剂能鉴别苯酚溶液、戊烯、己烷、乙醇四种液体的是( )
| A. | 溴水 | B. | 新制Cu(OH)2悬浊液 | C. | NaOH溶液 | D. | 水 |
18.将2g氢氧化钠固体分别加入下列100mL溶液中,导电能力变化最小的是( )
| A. | 自来水 | B. | 0.5mol/L的盐酸 | ||
| C. | 0.5mol/L的醋酸 | D. | 0.5mol/L的氯化钾溶液 |
5.一定条件下,钠能跟二氧化碳发生如下反应:4Na+3CO2=2Na2CO3+C.由此反应不能说明的是( )
| A. | 钠显示了强还原性 | B. | 二氧化碳是酸性氧化物 | ||
| C. | 金属钠熔点较低 | D. | 二氧化碳也能起助燃作用 |
2.T℃时,N2与H2反应生成NH3,其能量变化如图(Ⅰ)所示.若保持其他条件不变,温度分别为T1℃和T2℃时,H2的体积分数与时间的关系如图(Ⅱ)所示.则下列结论不正确的是( )
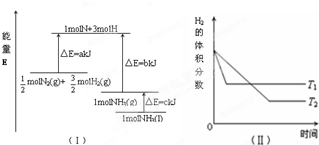

| A. | 该反应的热化学方程式:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-(b-a)kJ•mol-1 | |
| B. | 该反应的热化学方程式:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ•mol-1 | |
| C. | T1>T2,且正反应为放热反应 | |
| D. | 其他条件不变,升高温度,正、逆反应速率均增大,且H2的转化率增大 |