题目内容
18.将2g氢氧化钠固体分别加入下列100mL溶液中,导电能力变化最小的是( )| A. | 自来水 | B. | 0.5mol/L的盐酸 | ||
| C. | 0.5mol/L的醋酸 | D. | 0.5mol/L的氯化钾溶液 |
分析 电解质的导电能力,主要取决于离子浓度的大小,浓度越大,导电能力越强,把2g氢氧化钠固体分别加入下列100mL溶液中,溶液的导电能力变化最小,溶液的离子浓度应变化最小,以此解答该题.
解答 解:A、因水是极弱的电解质,导电性极弱,加入氢氧化钠后,氢氧化钠是强电解质,溶液中主要的是钠离子和氢氧根,导电性增强,故A错误;
B、未加氢氧化钠固体,导电的有氯离子和氢离子,加入氢氧化钠后发生中和反应生成氯化钠,而参加反应的氢离子正好与钠离子的量相当,所以导电性变化不大,故B正确;
C、原来醋酸是弱电解质,离子较少,加入强碱以后,变为强电解质,导电能力增强,故C错误;
D、氯化钾属于强电解质,加入NaOH后即加入了强电解质,离子的浓度变化加倍,故导电性加倍,故D错误;
故选B.
点评 本题考查溶液中离子浓度大小比较,以此判断溶液的导电性,溶液混合后导电能力变化的大小,关键是看混合后溶液中自由移动的离子浓度的变化.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列离子方程式书写正确的是( )
| A. | 向Ba(OH)2溶液中加稀硫酸:Ba2++OH-+H++SO42?═BaSO4↓+H2O | |
| B. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 向小苏打溶液中加入少量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 足量CO2通入NaOH溶液:CO2+2 OH-═CO32-+H2O |
9.下列关于胶体的说法正确的是( )
| A. | 直径介于1-100纳米之间的微粒称为胶体 | |
| B. | 当光束通过胶体时,看到的“光柱”是由于光被胶体粒子散射而形成的 | |
| C. | 胶体的分散质不能透过滤纸的孔隙 | |
| D. | 溶液时电中性的,胶体是带电的 |
6.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )
| A. | 1molCH3+所含的电子数为9NA | |
| B. | 标准状况下,11.2 L HF的分子数为0.5NA | |
| C. | 39 g Na2O2与足量水反应,转移电子数为NA | |
| D. | 1 mol乙醇中含有共用电子对数为8NA |
13.硝酸与金属反应往往产生氮氧化物,但是在某些特殊情况则不然.将稀硝酸(HNO3浓度低于2mol•L一1)与过量金属镁缓和反应放出一种无色无毒气体A,反应完全后向剩余溶液中加人过量NaOH固体并加热,放出气体B,将两次放出气体全部收集并混合,用碱石灰干燥后缓慢通过足量的灼热氧化铜固体,观察到固体变红,将剩余气体用浓硫酸干燥,最后气体体积变为原来的四分之三,则下列分析正确的是(本题中所有气体体积均为相同条件下测得的体积)( )
| A. | 无色无毒气体A为H2 | |
| B. | 最后气体为NH3 | |
| C. | 在镁与硝酸反应过程中还原剂与氧化剂的物质的量之比为5:1 | |
| D. | 气体A与气体B的体积比为1:1 |
3.下列说法正确的是( )
| A. | 苯分子可表示为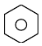 ,其邻二氯代物有2种结构 ,其邻二氯代物有2种结构 | |
| B. | 等物质的量C2H4、C3H6完全燃烧,消耗等质量的O2 | |
| C. | 蛋白质的水解和油脂的皂化都是由高分子生成小分子的过程 | |
| D. | 利用CH4和Cl2的取代反应可制取溶剂CCl4 |
10.下列酸溶液的pH相同时,其物质的量浓度最小的是( )
| A. | H2S | B. | H2SO4 | C. | HClO | D. | HNO3 |
8.化学与材料、生活和环境密切相关,下列有关分类中正确的是( )
| A. | 新型材料聚酯纤维、光导纤维都属于有机高分子 | |
| B. | 火柴头的主要成分是氯酸钾和硫单质,分别属于电解质和非电解质 | |
| C. | 蛋白质、淀粉、纤维素都属于有机高分子化合物 | |
| D. | 天然纤维和合成纤维的主要成分是纤维素 |