题目内容
12.下列叙述不正确的是( )| A. | 热水中加入硫酸钠溶解至饱和,此时溶液的pH小于7 | |
| B. | 物质的量浓度相等的H2S和NaHS混合溶液中:2c(Na+)═c(S2-)+c(HS-)+c(H2S) | |
| C. | pH=13的强碱溶液,加水稀释后,溶液中氢离子的浓度变小 | |
| D. | 25℃时pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,溶液中由水电离产生的氢离子的浓度之比为104 |
分析 A.升高温度促进水电离,导致溶液中c(H+)增大;
B.物质的量浓度相等的H2S和NaHS混合溶液中存在物料守恒,根据物料守恒判断;
C.pH=13的强碱溶液,加水稀释后溶液中c(OH-)减小,温度不变,水的离子积常数不变,据此判断c(H+)变化;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离.
解答 解:A.升高温度促进水电离,导致溶液中c(H+)增大,溶液的pH减小,所以热水中加入硫酸钠溶解至饱和,此时溶液的pH小于7,故A正确;
B.物质的量浓度相等的H2S和NaHS混合溶液中存在物料守恒,根据物料守恒得2c(Na+)═c(S2-)+c(HS-)+c(H2S),故B正确;
C.pH=13的强碱溶液,加水稀释后溶液中c(OH-)减小,温度不变,水的离子积常数不变,则c(H+)变大,故C错误;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离,25℃时pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,溶液中由水电离产生的c(H+)之比=10-5 mol/L:10-9 mol/L=104,故D正确;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质、溶质对水电离影响是解本题关键,易错选项是D,注意酸碱盐溶液中水电离出c(H+)的计算方法,题目难度中等.

练习册系列答案
相关题目
5.在下列变化中,一定需要另外加入氧化剂才能实现的是( )
| A. | HCl→H2 | B. | Br-→Br2 | C. | Fe2O3→Fe | D. | KMnO4→O2 |
4.A、B、C均为短周期元素,A、B周周期,A、C的最低价阴离子分别为A2-、C-,A2-离子半径大于C-,B2+与C-具有相同的电子层结构.下列叙述一定不正确的是( )
| A. | 它们的原子序数B>A>C | B. | 它们的离子半径A2->C->B2+ | ||
| C. | 它们的原子半径C>B>A | D. | 它们的最外层电子数C>A>B |
7.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 23g Na在空气中完全燃烧,转移的电子数为1 mol | |
| B. | 78gNa2O2含有的离子数为3NA | |
| C. | 0.1 mol Fe与足量水蒸气反应生成H2的分子数为0.1NA | |
| D. | 5.4 g铝与足量NaOH溶液反应,产生6.72L的氢气 |
17.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):③>②>① | |
| B. | 0.2mol•L-1 CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| C. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 常温下,向0.1mol/L NH4HSO4溶液中滴加NaOH溶液至中性c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
1.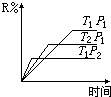 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2S(?),此反应符合下面图象,下列叙述是正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2S(?),此反应符合下面图象,下列叙述是正确的是( )
 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2S(?),此反应符合下面图象,下列叙述是正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2S(?),此反应符合下面图象,下列叙述是正确的是( )| A. | 正反应吸热,S是气体 | B. | 正反应吸热,S是固体 | ||
| C. | 正反应放热,S是气体 | D. | 正反应放热,S是固体或液体 |
1.下列离子在溶液中能大量共存的是( )
| A. | Cu2+ Na+ NO3- S2- | B. | Mg2+ H+ SO42- NO3- | ||
| C. | Al3+ Na+ HCO3- SO42- | D. | Fe3+ H+ SCN- Cl- |
 回答下列问题.
回答下列问题.