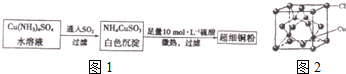
题目内容
11.现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图1所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B、G为原子晶体,工业上利用单质A的同素异形体与B物质发生置换反应来制取单质G的粗产品.C、D、E、F均含有10个电子,且D是阳离子,D与F的组成元素相同.C、E、F为分子晶体,E常温下呈液态.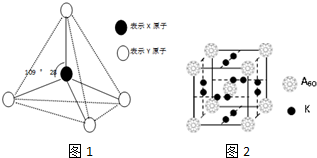
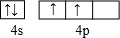
(1)与A同主族的第四周期元素基态原子的价电子排布图为
 .
.(2)D的中心原子J的杂化类型为sp3,F易溶于E,其原因是氨分子与水分子间形成氢键.
(3)科学家把A60和钾(K)掺杂在一起制造出了一种化合物,其晶胞如图2所示,该物质在低温时是一种超导体.其化学式为K3C60.
继A60后,科学家又合成了G60、J60,A、G、J原子电负性由大到小的顺序是N>C>Si(填元素符号).G60分子中每个G原子只跟相邻的3个G原子形成共价键,且每个G原子最外层都满足8电子稳定结构,则1mol G60分子中π键的数目为1.806×1025.
(4)已知某红紫色配合物为CoCl3•5F•H2O,其水溶液显弱酸性,加入强碱无现象,加热至沸腾有F放出,同时产生Co2O3沉淀.加AgNO3于该配合物溶液中,有AgCl沉淀生成,过滤后加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成,且其质量为第一次沉淀量的二分之一.则该配合物的化学式为[CoCl(NH3)5]Cl2•H2O.
分析 A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有正四面体结构或结构单元,D是阳离子,故D为NH4+;C、D、E、F含有相等的电子数,故电子数为10,D与F的组成元素相同,故F为NH3;由E构成的物质常温下呈液态,故E为H2O;C、E、F的晶体类型相同,属于分子晶体,故C为CH4;A、B的晶体类型相同,单质A的同素异形体能与B物质发生置换反应,A为金刚石,B为二氧化硅,G为Si.
解答 解:A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有正四面体结构或结构单元,D是阳离子,故D为NH4+;C、D、E、F含有相等的电子数,故电子数为10,D与F的组成元素相同,故F为NH3;由E构成的物质常温下呈液态,故E为H2O;C、E、F的晶体类型相同,属于分子晶体,故C为CH4;A、B的晶体类型相同,单质A的同素异形体能与B物质发生置换反应,A为金刚石,B为二氧化硅,G为Si.
(1)与A同主族的第四周期元素处于第四周期IVA族,基态原子的价电子排布图为 ,故答案为:
,故答案为: ;
;
(2)D为NH4+,中心原子J为N,中N原子价层电子对数为4,杂化类型为sp3杂化,F为NH3,易溶于原因是氨分子与水分子间形成氢键,
故答案为:sp3;氨分子与水分子间形成氢键;
(3)晶胞中C60分子数目为8×$\frac{1}{8}$+1=2,K原子数目为2×6×$\frac{1}{2}$=6,故化学式为:K3C60,
同一周期,从左到右,电负性逐渐增大,同一主族,从上到下,电负性逐渐减小,因此,原子电负性由大到小的顺序是:N>C>Si,
每个硅形成的这3个键中,必然有1个双键,这样每个硅原子最外层才满足8电子稳定结构.显然,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30,则1mol G60分子中π键的数目为 1.806×1025,
故答案为:K3C60;N>C>Si;1.806×1025;
(4)CoCl3•5NH3•H2O水溶液加AgNO3于该化合物溶液中,有AgCl沉淀生成,说明外界离子有Cl-,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成,说明配体中含有Cl-,且其质量为第一次沉淀量的二分之一,说明外界离子有Cl-与配体Cl-之比为2:1,该配离子化学式可能为[CoCl(NH3)5]Cl2•H2O,
故答案为:[CoCl(NH3)5]Cl2•H2O.
点评 本题是对物质结构与性质的考查,涉及微粒推断、配合物、晶胞计算等,利用均摊法进行晶胞有关计算,理解配合物中内界与外界性质的不同,难度中等.

 常温下,将0.20mol/L H2X溶液与0.20mol/L NaOH溶液等体积混合,所得溶液pH=3.6,继续滴加NaOH溶液至pH=4.0时,部分粒子浓度如下图所示.下列说法错误的是( )
常温下,将0.20mol/L H2X溶液与0.20mol/L NaOH溶液等体积混合,所得溶液pH=3.6,继续滴加NaOH溶液至pH=4.0时,部分粒子浓度如下图所示.下列说法错误的是( )| A. | 图中a代表Na+,d代表H2X分子 | |
| B. | H2X为二元弱酸,HX-的电离程度大于水解程度 | |
| C. | 混合溶液pH=3.6时:c(H+)+c(H2X)=c(X2-)+c(OH-) | |
| D. | 继续滴加NaOH溶液至pH=7.0时:c(Na+)>c(HX-)+2c(X2-) |
| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |

| A. | 装置①:可用于吸收NH3或HCl气体,并防止倒吸 | |
| B. | 装置②:持续通入CO2气体,先出现白色沉淀,后变澄清 | |
| C. | 装置③:若“a进b出”可用于收集NO2,若“b进a出”可用于收集NH3 | |
| D. | 装置④:可用于分离石油,得到汽油、煤油和柴油等各种纯净物 |
| A. | 向NaHCO3溶液中通CO2至pH=7:c(Na+)=c(HCO3-)+2c(CO32-) | |
| B. | 向CH3COONa溶液中加入等浓度等体积的盐酸:c(Na+)=c(Cl-) | |
| C. | 向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH=13 | |
| D. | 向氨水中加入少量NH4Cl固体:$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
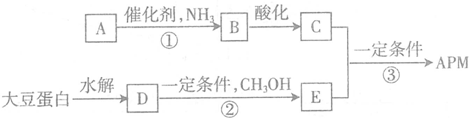
 .C中所含官能团的名称为羧基、氨基.
.C中所含官能团的名称为羧基、氨基. .
.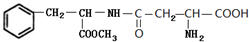 和
和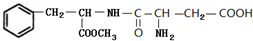 .
.


 .
. 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式 ,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.
,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.