题目内容
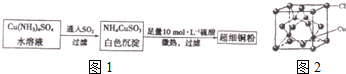
12.某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质离子.某小组在实验室中用浸出萃取法制备硫酸铜:
(1)操作Ⅰ为过滤.操作Ⅱ用到的玻璃仪器有烧杯、分液漏斗.
(2)操作Ⅱ、操作Ⅲ的主要目的是除去杂质、富集铜元素.
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液.多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4.
已知Cu(OH)2、Cu2(OH)2CO3,Cu4(OH)6SO4均难溶于水,可溶于酸;分解温度依次为80℃、200℃、300℃.
设计实验检验悬浊液成分,完成表中内容.
限选试剂:2 mol•L-1 HCl、1 mol•L-1 H2SO4、0.1 mol•L-1 NaOH、0.1 mol•L-1BaCl2、蒸馏水.仪器和用品自选.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,加入过量2mol/L的盐酸溶液,充分振荡,再滴加几滴0.1mol/L氯化钡溶液 | 有白色沉淀生成说明悬浊液中混有Cu4(OH)6SO4. |
| 步骤2:另取少量悬浊液于试管中,将试管放入装有沸水的小烧杯中水浴加热一段时间取出试管观察 | 试管中有黑色固体生成,说明悬浊液中混有Cu(OH)2. |
分析 铜矿石溶于酸,然后采用过滤方法将难溶性固体和溶液分离,则操作I为过滤;然后向滤液中加入有机物采用萃取方法将含铜物质和溶液分离,所以操作II为萃取,得到的有机相中含有铜元素,再采用硫酸最萃取剂将含铜有机相萃取,得到硫酸铜溶液和有机相,将硫酸铜溶液加热浓缩、冷却结晶得到硫酸铜晶体,
(1)操作Ⅰ是酸溶后分离固体和溶液,操作是过滤;操作II是分离互不相溶的液体,实验操作是分液,
(2)依据操作II、操作III得到的物质和实验目的,浸出-萃取法制备硫酸铜,水相和有机相为了除去杂质;
(3)证明含有Cu4 ((OH)6SO4,可以证明硫酸根离子的存在设计实验验证;氢氧化铜的存在可以利用加热悬浊液氢氧化铜分解生成黑色的氧化铜沉淀分析回答;
(4)依据铜元素守恒结合物质的量计算晶体质量.
解答 解:铜矿石溶于酸,然后采用过滤方法将难溶性固体和溶液分离,则操作I为过滤;然后向滤液中加入有机物采用萃取方法将含铜物质和溶液分离,所以操作II为萃取,得到的有机相中含有铜元素,再采用硫酸最萃取剂将含铜有机相萃取,得到硫酸铜溶液和有机相,将硫酸铜溶液加热浓缩、冷却结晶得到硫酸铜晶体,
(1)依据流程图分析操作Ⅰ是矿石酸溶后分离固体和液体的方法,实验操作是过滤;操作Ⅱ是加入有机物溶解铜的化合物且能和水分层,实验操作是分液,用到的玻璃仪器有烧杯、分液漏斗等,
故答案为:过滤;分液漏斗;
(2)利用水和有机溶剂萃取提纯硫酸铜溶液结晶得到硫酸铜晶体;操作II、操作III的主要目的是除去溶液中的杂质,
故答案为:除去杂质;
(3)利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂 Cu2(0H)2C03悬浊液,由于条件控制不同使其中混有较多Cu(OH)2或Cu4(0H)6S04.实验验证杂质的存在,可以检验是否含硫酸根离子检验Cu4(0H)6S04的存在,加入盐酸排除其他离子的干扰,加入氯化钡生成白色沉淀证明含Cu4(0H)6S04;依据氢氧化铜受热分解生成氧化铜黑色沉淀设计实验来分析验证,取少量悬浊液于试管中利用沸水浴加热试管;试管中有黑色沉淀生成证明含Cu(OH)2;水浴加热的目的是避免温度过高氧化铜分解;
故答案为:
| 实验步骤 | 预期现象和结论 |
| 加入过量2mol/L的盐酸溶液,充分振荡,再滴加几滴0.1mol/L氯化钡溶液 | 有白色沉淀生成 |
| 将试管放入装有沸水的小烧杯中水浴加热一段时间取出试管观察 | 试管中有黑色固体生成 |
故答案为:12.5.
点评 本题考查物质制备方案的设计,为高频考点,题目难度中等,涉及物质成分检验、基本实验操作等知识点,明确反应原理是解本题关键,难点是(3)题实验方案设计,知道常见物质的性质及颜色.

 新思维寒假作业系列答案
新思维寒假作业系列答案| A. | 向NaHCO3溶液中通CO2至pH=7:c(Na+)=c(HCO3-)+2c(CO32-) | |
| B. | 向CH3COONa溶液中加入等浓度等体积的盐酸:c(Na+)=c(Cl-) | |
| C. | 向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH=13 | |
| D. | 向氨水中加入少量NH4Cl固体:$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
| A. | 焰火的五彩缤纷是某些金属元素化学性质的体现 | |
| B. | 高纯度的单晶硅用于制造登月车的光电池和光导纤维 | |
| C. | 可溶性铜盐有毒,但在生命体中,铜是一种不可缺少的微量元素 | |
| D. | 用明矾可以将自来水净化成纯净水 |
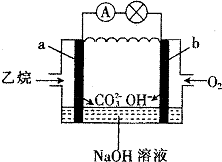
| A. | a为负极,电极反应式为CH3CH3-14e-+18OH-═2CO32-+12H2O | |
| B. | 电子从a极经导线移向b极,再经溶液移向a极 | |
| C. | 电池工作一段时间后电解质溶液的pH增大 | |
| D. | 用该电池电解硫酸铜溶液(电解池的电极为惰性电极),消耗氧气的物质的量与析出铜的物质的量之比为2:1 |
| A. | 标准状况下,22.4L H2O含有的分子数为 NA | |
| B. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| C. | 将等物质的量的SO3和SO2溶于水,所得溶液中H+数目相等 | |
| D. | 常温常压下,1.06g Na2CO3溶于水形成的溶液中含有Na+离子数为0.02 NA |

| A. | 向Na2SiO3溶液中滴入酚酞溶液无明显现象 | |
| B. | 试管①中反应的离子方程式是:Na2CO3+2H+═2Na++CO2↑+H2O | |
| C. | 该实验可以证明酸性:盐酸>碳酸>硅酸 | |
| D. | 若将盐酸换成硫酸,能证明酸性:硫酸>碳酸>硅酸 |