题目内容
6.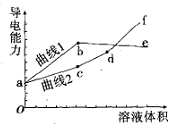 分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )
分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )| A. | 曲线2 代表滴加NH3•H2O溶液的变化曲线 | |
| B. | b和d点对应的溶液均显碱性 | |
| C. | b点溶液中c(NH4+ )>c(SO42- )>c(H+ )>c(OH- ) | |
| D. | df段导电能力升高的原因是发生了反应Al(OH)3+OH-═[Al(OH)4]- |
分析 溶液中离子浓度越大,导电性越强;分别用浓度均为0.5mol/L NH3•H2O和NaOH溶液滴定20 mL 0.01mol/L Al2(SO4)3溶液,一水合氨滴入发生反应:6NH3•H2O+Al2(SO4)3=2Al(OH)3↓+3(NH4)2SO4,氢氧化钠溶液滴入发生的反应为:6NaOH+Al2(SO4)3=2Al(OH)3↓+3Na2SO4 ,Al(OH)3+NaOH═Na[Al(OH)4],所以曲线1为氨水滴入的反应,曲线2位氢氧化钠滴入的反应,据此分析选项.
解答 解:A.一水合氨滴入发生反应:6NH3•H2O+Al2(SO4)3=2Al(OH)3↓+3(NH4)2SO4,氢氧化钠溶液滴入发生的反应为:6NaOH+Al2(SO4)3=2Al(OH)3↓+3Na2SO4 ,Al(OH)3+NaOH=NaAlO2+2H2O,所以曲线1为氨水滴入的反应,曲线2位氢氧化钠滴入的反应,故A错误;
B.b点为硫酸铵溶液,铵根水解溶液显酸性,d点是NaAlO2溶液,偏铝酸根离子水解溶液显碱性,故B错误;
C.b点为硫酸铵溶液,铵根水解溶液显酸性,溶液中离子浓度大小关系为c(NH4+ )>c(SO42- )>c(H+ )>c(OH- ),故C正确;
D.d点是NaAlO2溶液,d点以后氢氧化钠过量,溶液中离子浓度增大,导电性增强,故D错误;
故选C.
点评 本题考查了电解质溶液反应前后溶液导电性的分析判断,主要是离子浓度变化决定溶液导电的变化,注意图象变化的实质理解,题目难度中等,侧重于考查学生的分析能力和应用能力..

练习册系列答案
相关题目
11.对某温度下的可逆反应N2(g)+3H2(g)?2NH3(g).下列事实能说明该反应达到化学平衡状态的是( )
| A. | N2、H2的浓度之比保持不变 | |
| B. | N2和H2的反应速率之比为1:3 | |
| C. | NH3的生成速率与H2的生成速率之比为2:3 | |
| D. | 体系中N2、H2、NH3的分子个数之比为1:3:2 |
17.将质量为m1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体11.2L.向溶液中逐滴加入浓度为4mol•L-1的HCl溶液,至100mL时白色沉淀达到最大量.继续滴入HCl溶液,当加入HCl溶液体积VmL时沉淀恰好消失.将所得溶液蒸干灼烧得固体m2g.下列关系式中不正确的是( )
| A. | V=150 mL | B. | m1=14.6g | ||
| C. | 白色沉淀最大量为15.6g | D. | m2=10.2g |
1.某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol•L-1.
甲同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
②取少量溶液,加入KSCN溶液无明显变化.
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由①、②、③判断,溶液中一定不含有的阳离子是K+、Fe3+,一定不含的阴离子是CO32-、SiO32-(写离子符号).
(2)③中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,④中生成白色沉淀的离子方程式是SO42-+Ba2+=BaSO4↓.
(3)将③中所得红棕色气体通入水中,气体变无色,所发生的化学反应方程式为3NO2+H2O=2HNO3+NO.
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Mg2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
| 阳离子 | K+ Mg2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl-CO32- NO3- SO42- SiO32- |
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
②取少量溶液,加入KSCN溶液无明显变化.
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由①、②、③判断,溶液中一定不含有的阳离子是K+、Fe3+,一定不含的阴离子是CO32-、SiO32-(写离子符号).
(2)③中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,④中生成白色沉淀的离子方程式是SO42-+Ba2+=BaSO4↓.
(3)将③中所得红棕色气体通入水中,气体变无色,所发生的化学反应方程式为3NO2+H2O=2HNO3+NO.
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Mg2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
11.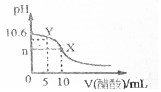 已知常温下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.01mol•L-1的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示.已知100.4=2.5.下列说法错误的是( )
已知常温下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.01mol•L-1的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示.已知100.4=2.5.下列说法错误的是( )
 已知常温下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.01mol•L-1的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示.已知100.4=2.5.下列说法错误的是( )
已知常温下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.01mol•L-1的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示.已知100.4=2.5.下列说法错误的是( )| A. | n=7 | |
| B. | 水的电离程度先增大再减小 | |
| C. | 常温下醋酸的电离常数约是1.67×10-5 | |
| D. | Y点溶液中c(NH3•H2O)+c(OH-)=c(CH3COO-)+c(H+) |
18.在一个绝热的容积固定的密闭容器中发生可逆反应:mA(g)+nB(g)?pC(g)+qD(g),当 m、n、p、q 为任意整数时,反应达到平衡的标志是:①体系的密度不再改变,②体系的温度不再改变,③A 的转化率不再改变,④各组分的百分含量不再改变,⑤反应 速率,v(A):v(B):v(C):v(D)=m:n:p:q.下列组合完全正确的是( )
| A. | ②③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②③④⑤ |
15.下列关于材料的说法正确的是( )
| A. | 玻璃属于非金属材料,其主要成分是碳酸盐 | |
| B. | 玻璃钢是一种复合材料,由塑料和铁丝复合而成 | |
| C. | 有机物合成材料属于高分子材料,在汽车轮胎、棉花、塑料制品中都存在 | |
| D. | 氮化硅陶瓷是新型无机非金属材料 |
16.下列水解化学方程式或水解离子方程式正确的是( )
| A. | CH3COO-+H2O?CH3COOH+OH- | B. | HCO3-+H2O?CO32-+H3O+ | ||
| C. | CH3COOH+OH-?CH3COO-+H2O | D. | NaCl+H2O?NaOH+HCl |
