题目内容
可逆反应aA(?)+2B(g)?2C(g)+D(g),其中a为正整数.反应中当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )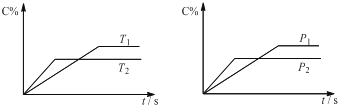

| A、达到平衡后,加入催化剂则C%增大 |
| B、达到平衡后,若升高温度,平衡正向移动 |
| C、a可以为任意的正整数 |
| D、达平衡后,增加A的量,有利于平衡正向移动 |
考点:体积百分含量随温度、压强变化曲线
专题:化学平衡专题
分析:由左图可知,温度T2到达平衡所用的时间短,故温度T2>T1,温度越高,平衡时C的百分含量(C%)越小,升高温度平衡向逆反应移动,故该反应的正反应为放热反应;
由右图可知,压强p2到达平衡所用的时间短,故压强p2>p1,压强越大,平衡时C的百分含量(C%)越小,增大压强平衡向逆反应移动,故该反应正反应为气体物质的量增大的反应,所以A不是气态.据此结合平衡移动原理解答.
由右图可知,压强p2到达平衡所用的时间短,故压强p2>p1,压强越大,平衡时C的百分含量(C%)越小,增大压强平衡向逆反应移动,故该反应正反应为气体物质的量增大的反应,所以A不是气态.据此结合平衡移动原理解答.
解答:
解:由左图可知,温度T2到达平衡所用的时间短,故温度T2>T1,温度越高,平衡时C的百分含量(C%)越小,升高温度平衡向逆反应移动,故该反应的正反应为放热反应;
由右图可知,压强p2到达平衡所用的时间短,故压强p2>p1,压强越大,平衡时C的百分含量(C%)越小,增大压强平衡向逆反应移动,故该反应正反应为气体物质的量增大的反应,所以A不是气态.
A、加入催化剂同等程度增大正逆反应速率,平衡不移动,C的百分含量C%不变,故A错误;
B、温度越高,平衡时C的百分含量(C%)越小,升高温度平衡向逆反应移动,故B错误;
C、压强越大,平衡时C的百分含量(C%)越小,增大压强平衡向逆反应移动,故该反应正反应为气体物质的量增大的反应,A为固体,逆反应为气体体积减少的反应,故a可以为任意正整数,故C正确;
D、A不是气态,增大非气态物的物质的量不能使平衡移动,故D错误.
故选:C.
由右图可知,压强p2到达平衡所用的时间短,故压强p2>p1,压强越大,平衡时C的百分含量(C%)越小,增大压强平衡向逆反应移动,故该反应正反应为气体物质的量增大的反应,所以A不是气态.
A、加入催化剂同等程度增大正逆反应速率,平衡不移动,C的百分含量C%不变,故A错误;
B、温度越高,平衡时C的百分含量(C%)越小,升高温度平衡向逆反应移动,故B错误;
C、压强越大,平衡时C的百分含量(C%)越小,增大压强平衡向逆反应移动,故该反应正反应为气体物质的量增大的反应,A为固体,逆反应为气体体积减少的反应,故a可以为任意正整数,故C正确;
D、A不是气态,增大非气态物的物质的量不能使平衡移动,故D错误.
故选:C.
点评:本题考查了体积分数随温度、压强变化曲线的分析,难度不大,明确“先拐先平数值大”是解本题的关键.

练习册系列答案
相关题目
某氯碱厂利用废铁皮制取净水剂FeCl3溶液,最合理的生产途径是( )
A、Cl2
| |||||||||
B、Cl2
| |||||||||
C、Cl2
| |||||||||
D、 |
在一密闭容器中充入NO2,在一定条件下进行反应:2NO2?2NO+O2.达到平衡状态的标志是( )
| A、NO2的消耗速率与NO的生成速率相等 |
| B、容器内压强不随时间变化而变化 |
| C、NO和O2的消耗速率之比为2:1 |
| D、单位时间内生成2n mol NO同时生成n mol O2 |
卤代烃RCH2CH2X的化学键如图,则下列说法中正确的是( )
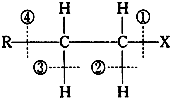

| A、当卤代烃发生水解反应时,被破坏的键是①和④ |
| B、当卤代烃发生水解反应时,被破坏的键是① |
| C、当卤代烃发生消去反应时,被破坏的键是①和③ |
| D、当卤代烃发生消去反应时,被破坏的键是①和② |
实验室用锌粒与VmL浓度为10%的稀硫酸反应制取氢气,若向反应混合物中加入下列物质,关于反应速率v说法正确的是( )
| A、少量BaCl2固体,v(H2)减小 |
| B、VmLNa2SO4溶液,v(H2)不变 |
| C、VmL浓盐酸,v(H2)增大 |
| D、VmL稀硝酸,v(H2)增大 |
 某研究性学习小组对双氧水开展如下研究.
某研究性学习小组对双氧水开展如下研究.