题目内容
实验室用锌粒与VmL浓度为10%的稀硫酸反应制取氢气,若向反应混合物中加入下列物质,关于反应速率v说法正确的是( )
| A、少量BaCl2固体,v(H2)减小 |
| B、VmLNa2SO4溶液,v(H2)不变 |
| C、VmL浓盐酸,v(H2)增大 |
| D、VmL稀硝酸,v(H2)增大 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:对应锌与稀硫酸的反应,增大稀硫酸浓度、升高反应温度、增大固体的表面积以及形成原电池反应都可增大反应速率,以此解答该题.
解答:
解:A.加入少量BaCl2固体,氢离子物质的量不变,反应速率不变,故A错误;
B.加入VmLNa2SO4溶液,氢离子物质的量不变,但溶液体积增大,则反应速率减小,故B错误;
C.加入VmL浓盐酸,氢离子浓度增大,反应速率增大,故C正确;
D.硝酸具有强氧化性,可与锌反应生成NO,不生成氢气,故D错误.
故选C.
B.加入VmLNa2SO4溶液,氢离子物质的量不变,但溶液体积增大,则反应速率减小,故B错误;
C.加入VmL浓盐酸,氢离子浓度增大,反应速率增大,故C正确;
D.硝酸具有强氧化性,可与锌反应生成NO,不生成氢气,故D错误.
故选C.
点评:本题考查影响化学反应速率的因素,为高频考点,注意温度、浓度、压强、接触面积、原电池反应等对反应速率的影响即可解答,易错点为D,注意硝酸的性质,难度不大.

练习册系列答案
相关题目
在一定条件下,下列物质可与甲烷发生化学反应的是( )
| A、溴水 | B、氯水 |
| C、氧气 | D、高锰酸钾溶液 |
可逆反应aA(?)+2B(g)?2C(g)+D(g),其中a为正整数.反应中当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )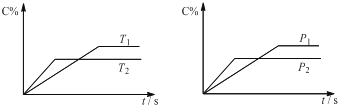

| A、达到平衡后,加入催化剂则C%增大 |
| B、达到平衡后,若升高温度,平衡正向移动 |
| C、a可以为任意的正整数 |
| D、达平衡后,增加A的量,有利于平衡正向移动 |
 某研究性学习小组的课题为“Mg、C原电池电解淀粉KI溶液的研究”,其研究装置如图所示.下列有关说法不正确的是( )
某研究性学习小组的课题为“Mg、C原电池电解淀粉KI溶液的研究”,其研究装置如图所示.下列有关说法不正确的是( )| A、镁为负极,发生氧化反应 |
| B、原电池中碳极反应式为Fe3++e-═Fe2+ |
| C、电解池中阴极处变蓝 |
| D、电解池中阴极处变红 |
 将一定量的Mg、Al投入100mL一定的物质的量浓度的盐酸中,合金全部溶解.向所得溶液中滴加5mol/L的NaOH至过量,生成的沉淀的质量与加入NaOH的体积的关系如图所示.
将一定量的Mg、Al投入100mL一定的物质的量浓度的盐酸中,合金全部溶解.向所得溶液中滴加5mol/L的NaOH至过量,生成的沉淀的质量与加入NaOH的体积的关系如图所示.