��Ŀ����
12���������棨CeO2����һ����Ҫ��ϡ�������ƽ�������ʾ�����������в��������ķϲ�����ĩ����SiO2��Fe2O3��CeO2�Լ���������������ϡ������ʣ���ij�������Դ˷�ĩΪԭ�ϻ����棬���ʵ���������£�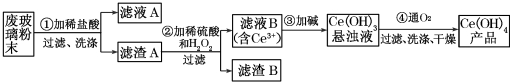
��1��ϴ������A��Ŀ���dz�ȥFe3+�������ӷ��ţ�������������Ƿ�ϴ���ķ�����ȡ���һ��ϴ��Һ������KSCN��Һ���������ֺ�ɫ������ϴ������֮��δϴ����
��2���ڢڲ���Ӧ�����ӷ���ʽ��6H++H2O2+2CeO2=2Ce3++O2 ��+4H2O������B����Ҫ�ɷ���SiO2��
��3����ȡ�Ƿ���ϡ��Ԫ�صij��÷�������֪������TBP��Ϊ��ȡ���ܽ������Ӵ�ˮ��Һ����ȡ������TBP���ܣ���ܡ����ܡ�����ˮ���ܣ�ʵ���ҽ�����ȡ����ʱ�õ�����Ҫ���������з�Һ©�����ձ�������������Ͳ�ȣ�
��4��ȡ���������еõ���Ce��OH��4��Ʒ0.536g���������ܽ����0.100 0mol•L-1 FeSO4����Һ�ζ����յ�ʱ���汻��ԭΪCe3+��������25.00mL����Һ���ò�Ʒ��Ce��OH��4����������Ϊ97.0%��
���� ���ݸ÷�Ӧ����Ϊ����CeO2��SiO2��Fe2O3���м���ϡ���ᣬFe2O3ת��FeCl3��������Һ�У�����ΪCeO2��SiO2���ڼ���ϡ�����H2O2��CeO2ת��ΪCe3+������ΪSiO2���ۼ�����Ce3+ת��Ϊ��������ͨ��������Ce��+3����Ϊ+4���õ���Ʒ��
��1����������A�Ϻ���FeCl3��ȡ���һ��ϴ��Һ������KSCN��Һ���������ֺ�ɫ������ϴ������֮��δϴ����
��2������������ԭ��Ӧ�е��ӵ�ʧ�غ�������������BΪSiO2��
��3��������ȡ����ˮ�����ܣ�
��4�����ݵ����غ㽨����ϵʽ��Ce��OH��4��FeSO4��Ȼ����м������Ce��OH��4������������������������
��� �⣺��1������A�Ϻ���FeCl3��ϴ������A��Ŀ����Ϊ�˳�ȥFe3+��ȡ���һ��ϴ��Һ������KSCN��Һ���������ֺ�ɫ������ϴ������֮��δϴ����
�ʴ�Ϊ��Fe3+��ȡ���һ��ϴ��Һ������KSCN��Һ���������ֺ�ɫ������ϴ������֮��δϴ����
��2��ϡ���ᡢH2O2��CeO2���߷�Ӧ����ת��ΪCe2��SO4��3��O2��H2O����Ӧ�����ӷ���ʽΪ��6H++H2O2+2CeO2=2Ce3++O2 ��+4H2O������ϡ�����H2O2��CeO2ת��ΪCe3+��SiO2����Ӧ������B�ijɷ�ΪSiO2��
�ʴ�Ϊ��6H++H2O2+2CeO2=2Ce3++O2 ��+4H2O��SiO2��
��3��������TBP��Ϊ��ȡ���ܽ������Ӵ�ˮ��Һ����ȡ����������TBP������ˮ���ܣ�
�ʴ�Ϊ�����ܣ���Һ©����
��4��Ce��OH��4 ��FeSO4
0.0025mol 0.1000mol/L-1��0.025L
����m��Ce��OH��4��=0.0025mol��208g/mol=0.52g��
��Ʒ��Ce��OH��4����������Ϊ$\frac{0.52g}{0.536g}$��100%=97.01%��
�ʴ�Ϊ��97.0%��
���� �����Թ�������Ϊ���������컯ѧʵ�����������Ԫ�ؼ�������֪ʶ����ѧ���㡢������ԭ��Ӧ�����֪ʶ��

 �γ̴����Ծ�����100��ϵ�д�
�γ̴����Ծ�����100��ϵ�д� �¾�����ĩ���100��ϵ�д�
�¾�����ĩ���100��ϵ�д� ȫ�ܴ���100��ϵ�д�
ȫ�ܴ���100��ϵ�д�| A�� | I2���ǻ�ԭ���� | |
| B�� | Cu��IO3��2�������������ǻ�ԭ�� | |
| C�� | ���������뻹ԭ�������ʵ�����Ϊ13��2 | |
| D�� | ��1 mol�������μӷ�Ӧʱ�������������ʵ����ʵ���Ϊ11mol |
��NH4I=NH3��g��+HI��g��
��2HI��g��=H2��g��+I2��g��
��Ϊ���淴Ӧ���ﵽƽ��ʱ��c��H2��=0.5mol/L��c��HI��=4mol/L������¶��·�Ӧ�ٵ�ƽ�ⳣ��Ϊ��������
| A�� | 12mol2•L-2 | B�� | 16mol2•L-2�� | C�� | 20mol2•L-2 | D�� | 25mol2•L-2 |
| A�� | �����������е����������ڷ�Ӧ�������е������� | |
| B�� | ��Ӧ�������е����������������������е������� | |
| C�� | �Ͽ�1molH-H����1molCl-Cl�������յ������������γ�2molH-Cl�����ų������� | |
| D�� | �÷�Ӧ�У���ѧ��ֻת��Ϊ���� |
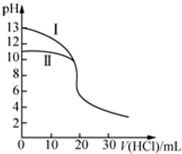
| A�� | ���ʾ���ǵζ���ˮ�����ߣ���V��HCl��=20 mLʱ��c��Cl-����c��NH4+����c��H+����c��OH-�� | |
| B�� | ��pH=7ʱ���ζ���ˮ���ĵ�V��HCl����20 mL����c��NH4+��=c��Cl-�� | |
| C�� | �ζ�����������Һʱ����V��HCl����20 mL����һ���У�c��Cl-����c��Na+����c��H+����c��OH-�� | |
| D�� | ���ζ���ˮ����V��HCl��=10 mLʱ���У�2[c��OH-��-c��H+��]=c��NH4+��-c��NH3•H2O�� |
| A�� | $\stackrel{235}{92}$U��$\stackrel{238}{92}$U����������ͬ��������ͬ��ͬ�ֺ��� | |
| B�� | ������Ϊ53��������Ϊ78�ĵ�ԭ�ӣ�$\stackrel{131}{53}$I | |
| C�� | ͬ��Ԫ�ص�ԭ�Ӿ�����ͬ���������������� | |
| D�� | ͨ����ѧ�仯����ʵ��16O��18O����ת�� |
| �¶�/�� | 25 | t1 | t2 |
| ˮ�����ӻ� | 1��10-14 | 1��10-13 | 1��10-12 |
��1��25��ʱ��ijNa2SO4��Һ��c��SO42-��=5��10-4 mol/L-1��ȡ����Һ1mL��ˮϡ����10mL����ϡ�ͺ���Һ��c��Na+����c��OH-��=1000��1��
��2����t2���£���amol•L-1CH3COOH��Һ��bmol•L-1NaOH��Һ�������Ϸ�Ӧ����Һǡ�ó����ԣ�����¶���CH3COOH�ĵ��볣��Ka=$\frac{b��1{0}^{-6}}{a-b}$����a��b��ʾ����
��1I����֪��25���£����з�Ӧ��
Ag+��aq��+2NH3��aq��?Ag2��NH3��2+��aq����H=akJ•mol-1 k=c
2Ag+��aq��+2OH-��aq��?Ag2O��s��+H2O��I����H=blJ•mol-1 k=d
��3��д��Ag2O���ڰ�ˮ����NH3��ʾ������������Һ[Ag��NH3��2+]���Ȼ�ѧ����ʽ��Ag2O��s��+H2O��l��+4NH3��aq��?2Ag��NH3��2+��aq��+2OH-��aq����H=��2a-b��kJ?mol-1������25���£��÷�Ӧ��ƽ�ⳣ������c��d��ʾ��k=$\frac{{c}^{2}}{d}$��

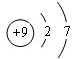 ��D���ӵĽṹʾ��ͼ��
��D���ӵĽṹʾ��ͼ��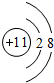 ��
��