题目内容
10.下列叙述正确的是:①35Li+中含有的中子数与电子数之比为2:1
②在C2H6分子中极性共价键与非极性共价键数之比为6:1
③常温下,11.2L的甲烷气体中含有的氢、碳原子数之比为4:1
④5.6g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2:1( )
| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
分析 ①根据原子符号的含义以及阳离子中核外电子数=核内质子数-电荷数;
②同种非金属元素之间形成非极性共价键,不同非金属元素之间形成极性共价键;
③根据甲烷的分子式来确定,与气体的体积无关;
④根据铁与足氯气反应,1个铁失去3个电子来判断,与铁的物质的量无关.
解答 解:①53Li+中含有的中子数为2与电子数为2,中子数与电子数之比为2:2,故①错误;
②在C2H6分子中极性共价键有6个,非极性共价键有1个,两者数目之比为6:1,故②正确;
③甲烷(CH4)气体中含有的氢、碳原子数之比为4:1,故③错误;
④5.6g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为3:1.故④错误;
故选C.
点评 本题考查同位素、核素的概念及质量数质子数、中子数之间的关系,难度不大,明确这几个概念间的区别.

练习册系列答案
相关题目
20.下列有关离子检验的实验结论不正确的是( )
| A. | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42- | |
| B. | 向某溶液中加入烧碱溶液,加热,用湿润红色石蕊试纸检验,石蕊试纸变蓝色,该溶液中一定含有NH4+ | |
| C. | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ | |
| D. | 向某溶液中加入硝酸酸化的硝酸银溶液,有白色沉淀生成,该溶液中一定含有Cl- |
1.常温下,下列离子能使纯水中的OH-离子数目增加的是( )
| A. | Al3+ | B. | CO32- | C. | NH4+ | D. | Br- |
18.下列叙述正确的是( )
| A. | 常温常压下,14g一氧化碳所占体积为11.2 L | |
| B. | 等物质的量的Na2O2和Na2O中所含阴阳离子总数相等 | |
| C. | NO的摩尔质量为30g | |
| D. | 常温常压下32g臭氧中含有的氧原子数目比标准状况下22.4L氧气中含有的氧原子数目少 |
5.在120℃时,在一密闭容器中有CO、H2、O2混合气体共28.5g,用电火花引燃,使其完全燃烧,再将燃烧后的气体用过量的Na2O2充分吸收,固体增重12.5g,则原混合气体中O2的物质的量是( )
| A. | 0.35mol | B. | 0.45 mol | C. | 0.50 mol | D. | 1.00mol |
15.ag SO2与 bg SO3所含氧原子个数相等,则a与b的比值为( )
| A. | 6:5 | B. | 2:3 | C. | 3:2 | D. | 1:1 |
2.下列烷烃在光照下与氯气反应,只生成一种一氯代物的是( )
| A. | CH3CH2CH2CH3 | B. | CH3CH(CH3)2 | C. | C(CH3)4 | D. | CH3CH(CH3)CH2CH3 |
4.有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸酸化的硝酸钡溶液,只有A中放出无色气体,只有D中产生白色沉淀;
⑤将B、C两溶液混合,未见沉淀或气体生成;
⑥A与E的溶液中具有相同的阳离子.根据上述实验填空:
(1)写出B、D的化学式:BKCl,DCuSO4;
(2)A受热分解的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(3)将含0.01mol A的溶液与含0.02mol E的溶液反应后,向溶液中滴加0.1mol•L-1稀盐酸.
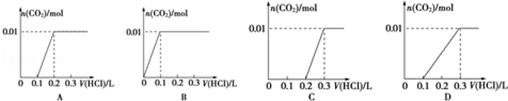
下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是C;
(4)向C中滴加过量E溶液,可用一个离子方程式表示Al3++4OH-=AlO2-+H2O;若在1L 0.1mol/L C溶液中加入175mL 2mol/L的E溶液,生成沉淀的物质的量是0.05mol.
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3-OH- Cl- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸酸化的硝酸钡溶液,只有A中放出无色气体,只有D中产生白色沉淀;
⑤将B、C两溶液混合,未见沉淀或气体生成;
⑥A与E的溶液中具有相同的阳离子.根据上述实验填空:
(1)写出B、D的化学式:BKCl,DCuSO4;
(2)A受热分解的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(3)将含0.01mol A的溶液与含0.02mol E的溶液反应后,向溶液中滴加0.1mol•L-1稀盐酸.
下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是C;

(4)向C中滴加过量E溶液,可用一个离子方程式表示Al3++4OH-=AlO2-+H2O;若在1L 0.1mol/L C溶液中加入175mL 2mol/L的E溶液,生成沉淀的物质的量是0.05mol.