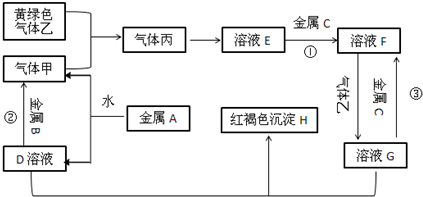
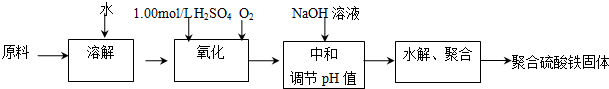
题目内容
19.在同温同压下,若要使A容器的氮气和B容器的氨气所含的原子总数相等,则这两个容器的体积之比是2:1.分析 同温同压下,气体摩尔体积相等,A、B容器中原子个数相等,则A、B容器中氮气和氨气的物质的量之比为2:1,根据V=nVm判断其体积关系.
解答 解:同温同压下,气体摩尔体积相等,A、B容器中原子个数相等,则A、B容器中氮气和氨气的物质的量之比为2:1,根据V=nVm知,相同条件下气体体积之比等于其物质的量之比,所以这两个容器体积之比为2:1,故答案为:2;1.
点评 本题考查了阿伏伽德罗定律及其推论,明确各个物理量之间的关系即可解答,题目难度不大.

练习册系列答案
相关题目
10.下列叙述正确的是:
①35Li+中含有的中子数与电子数之比为2:1
②在C2H6分子中极性共价键与非极性共价键数之比为6:1
③常温下,11.2L的甲烷气体中含有的氢、碳原子数之比为4:1
④5.6g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2:1( )
①35Li+中含有的中子数与电子数之比为2:1
②在C2H6分子中极性共价键与非极性共价键数之比为6:1
③常温下,11.2L的甲烷气体中含有的氢、碳原子数之比为4:1
④5.6g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2:1( )
| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
7.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸若a=7,则HA是强酸;若a>7,则HA是弱酸.
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2否 (选填“是”或“否”).
(3)丙组实验结果分析,HA是弱酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=10-5mol/L.
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | P H=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2否 (选填“是”或“否”).
(3)丙组实验结果分析,HA是弱酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=10-5mol/L.
14.A、B为短周期元素,它们的原子的最外层电子数相同,且A的原子半径小于B,若m为正整数,则下列说法正确的是( )
| A. | 若HnAOm是强酸,则HnBOm也一定为强酸 | |
| B. | 若一定条件下,金属A的单质能与水反应,则B的单质也一定能与水反应 | |
| C. | 常温下,若B的氢化物是气体,则A的氢化物也一定是气体 | |
| D. | A的单质可能从B的化合物中置换出B |
4.下列说法正确的是( )
| A. | SiO2(s)+2C(s)═Si(s)+2CO(g)只能在高温下自发进行,则该反应△H>0 | |
| B. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 | |
| C. | 合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率 | |
| D. | 25℃时,向0.1mol•L-1CH3COOH溶液滴加氨水,c(H+)/c(CH3COOH)增大 |
13.纯二氧化硅可用下列流程制得.下列说法不正确的是( )


| A. | X可用作木材防火剂 | |
| B. | 步骤II的反应是Na2SiO3+H2SO4═H2SiO3(胶体)+Na2SO4 | |
| C. | 步骤Ⅱ中的稀硫酸可用CO2来代替 | |
| D. | 步骤Ⅲ若在实验室完成,一般在蒸发皿中进行 |