题目内容
5.利用黄铜矿(CuFeS2)生产铜、绿矾的过程如下.根据题意完成下列各题: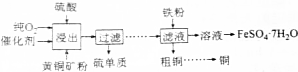
(1)CuFeS2中铜的化合价为+2价,则铁的化合价为+2.
(2)要从溶液中得到绿矾,必须进行的实验操作是bcae(按前后顺序填写字母序号).
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
(3)实验室中配制FeSO4溶液时常将绿矾溶于一定浓度的硫酸中,再加水稀释,这样操作的目的是抑制亚铁离子水解.
(4)绿矾产品的纯度可用滴定法进行测定,实验步骤如下:
步骤I.秤取6.000g绿矾产品,经溶解、定容等步骤准确配制250mL溶液.
步骤2:从上述容量瓶中量取25.00mL待测溶液于锥形瓶中.
步骤3:用硫酸酸化的0.0100mol/LKMnO4溶液滴定至终点,记录消耗KMnO4溶液的体积
步骤4:重复步骤2、步骤3两次、三次评价消耗KMnO4溶液40.00ml.
①判断此滴定实验达到终点的现象是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色
②写出滴定过程中发生反应的离子方程式MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
③计算上述样品中FeSO4•7H2O的质量分数为92.67%(保留四位有效值)
分析 (1)CuFeS2中铜的化合价为+2价,硫为-2价,根据元素化合价代数和为零确定铁的化合价;
(2)要从溶液中得到绿矾,可以通过蒸发浓缩,冷却结晶,过滤,洗涤,干燥等步骤;
(3)亚铁离子易水解,在配制硫酸亚铁溶液时要防止亚铁离子水解;
(4)①根据题中实验步骤可知,滴定实验达到终点时,溶液中的高锰酸钾不完全褪色,溶液呈浅红色;
②酸性KMnO4被FeSO4还原时生成Mn2+,同时生成铁离子,根据电荷守恒和元素守恒书写离子方程式;
③根据电子得失守恒有关系式MnO4-~5Fe2+,滴定中用去的高锰酸钾的物质的量为0.0100mol/L×0.04L=0.0004mol,所以6.000g绿矾产品中FeSO4•7H2O的物质的量为$\frac{250}{25}$×5×0.0004mol=0.02mol,据此计算样品中FeSO4•7H2O的质量分数.
解答 解:(1)CuFeS2中铜的化合价为+2价,硫为-2价,根据元素化合价代数和为零可和铁的化合价为+2价,
故答案为:+2;
(2)要从溶液中得到绿矾,可以通过蒸发浓缩,冷却结晶,过滤,洗涤,干燥等步骤,所以实验操作的序号为bcae,
故答案为:bcae;
(3)亚铁离子易水解,在配制硫酸亚铁溶液时要防止亚铁离子水解,所以将绿矾溶于一定浓度的硫酸中可以抑制亚铁离子水解,
故答案为:抑制亚铁离子水解;
(4)①根据题中实验步骤可知,滴定实验达到终点时,溶液中的高锰酸钾不完全褪色,溶液呈浅红色,所以判断滴定实验达到终点的现象是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色,
故答案为:滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色;
②酸性KMnO4被FeSO4还原时生成Mn2+,同时生成铁离子,反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
③根据电子得失守恒有关系式MnO4-~5Fe2+,滴定中用去的高锰酸钾的物质的量为0.0100mol/L×0.04L=0.0004mol,所以6.000g绿矾产品中FeSO4•7H2O的物质的量为:$\frac{250}{25}$×5×0.0004mol=0.02mol,所以样品中FeSO4•7H2O的质量分数为:$\frac{0.02×278}{6.000}$×100%=92.67%,
故答案为:92.67%.
点评 本题考查化学工艺流程、物质的分离提纯、氧化还原滴定应用、电解原理等知识,题目难度中等,明确实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | CO+H2O(g)═CO2+H2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
| A. | 一定有SO2、NH3和NO | B. | 一定有NO和HCl | ||
| C. | 可能有Cl2和O2 | D. | 一定没有Cl2、NO2、NH3和O2 |
| A. | SO2+H2O?H2SO3 | B. | SO2+2NaOH?Na2SO3+H20 | ||
| C. | 2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3 | D. | SO2+CaO═CaSO3 |
| A. | 3:2 | B. | 2:3 | C. | 4:1 | D. | 1:4 |
| A. | 钙和磷都是人体内含量丰富的矿物元素,属于常量元素 | |
| B. | 白色污染是指聚乙烯、聚氯乙烯等各种废塑料制品造成的污染 | |
| C. | 具有强吸附性的活性炭能吸附某些溶于水中的杂质,并能对水进行消毒 | |
| D. | 青霉素等抗生素对某些微生物有抑制或杀灭作用,但对人体细胞的毒性很低 |