题目内容
7.研究性学习小组欲用化学方法侧量一个不规则容器的体积.把35.1gNaCl放入500mL烧杯中,加入150mL蒸馏水.待NaCl完全溶解后,将溶液全部转移到容器中,用蒸馏水稀释到完全充满容器,从中取出溶液l00mL,该溶液怡好与20mL0.1mol/LAgNO3的溶液完全反应.(1)求100mLNaCl溶液的物质的量浓度(写出计算过程)
(2)试计算该容器的体积30L.
分析 (1)氯化钠与硝酸银发生反应:NaCl+AgNO3=AgCl↓+NaNO3,则n(NaCl)=n(AgNO3),再根据c=$\frac{n}{V}$计算NaCl溶液的物质的量浓度;
(2)根据n=$\frac{m}{M}$计算35.1gNaCl的物质的量,根据V=$\frac{n}{C}$;
解答 解:(1)氯化钠与硝酸银发生反应:NaCl+AgNO3=AgCl↓+NaNO3,100mL氯化钠溶液与20mL 0.1mol•L-1 AgNO3溶液恰好反应,则n(NaCl)=n(AgNO3)=0.02L×0.1mol•L-1=0.002mol,
故NaCl溶液的物质的量浓度为$\frac{0.002mol}{0.1L}$=0.02mol/L,
答:100mLNaCl溶液的物质的量浓度为0.02mol/L.
(2)35.1g NaCl的物质的量为$\frac{35.1g}{58.5g/mol}$=0.6mol,
则故NaCl溶液体积为$\frac{0.6mol}{0.02mol/L}$=30L,即该容器的体积为30L,
故答案为:30L
点评 本题考查物质的量浓度计算、化学方程式的有关计算,侧重于学生的分析能力和计算能力的考查,比较基础,注意对公式的理解与灵活运用.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
15.下列物质中只含离子键的化合物是( )
| A. | NaCl | B. | Fe | C. | HCl | D. | N2 |
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1 mol•L-1 NaOH溶液中Na+的数目为0.1 NA | |
| B. | 标准状况下,2.24 L CCl4中的分子数目为0.1 NA | |
| C. | 0.1 mol Na2O2与足量CO2反应转移的电子数目为0.1 NA | |
| D. | 3.2 g O2和O3的混合物含有的分子数目为0.1 NA |
17.镁铝合金4.08g溶于250mL2mol/L的盐酸中,标准状况下放出气体的体积为4.48L,向反应后的溶液中加入500mLNaOH溶液,充分反应后最终产生白色沉淀.下列有关说法不正确的是( )
| A. | 4.08g镁铝合金中含有镁和铝的质量分别为1.92g、2.16g | |
| B. | 生成沉淀的最大质量为10.88g | |
| C. | 若白色沉淀只有Mg(OH)2,该NaOH溶液的浓度至少为0.96mol/L | |
| D. | 溶解4.08 g镁铝合金时,剩余盐酸的物质的量为0.1 mol |
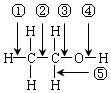 ,乙醇与钠反应时,断开的键是④;与HX反应时,断开的键是③;分子内脱水生成乙烯时,断开的键是①③;分子间脱水生成乙醚时,断开的键是③④;在铜催化作用下发生催化氧化反应时,断开的键是④⑤;酯化反应时,断开的键是④.
,乙醇与钠反应时,断开的键是④;与HX反应时,断开的键是③;分子内脱水生成乙烯时,断开的键是①③;分子间脱水生成乙醚时,断开的键是③④;在铜催化作用下发生催化氧化反应时,断开的键是④⑤;酯化反应时,断开的键是④.