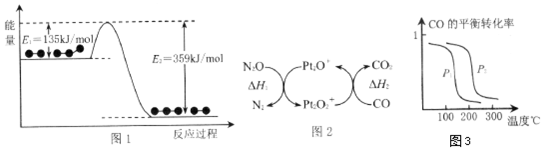
题目内容
12.将2L 0.2mol•L-1碳酸钠溶液与1L 0.1mol•L-1氢氧化钡溶液混合后过滤得到沉淀N,然后向滤液中加适量水稀释,最终得到4L溶液M.计算:(1)溶液M中c(CO32-)和c(OH-)分别是多少?
(2)沉淀N的质量是多少?
分析 n(Na2CO3)=0.2mol/L×2L=0.4mol,n(Ba(OH)2)=0.1mol/L×1L=0.1mol,二者发生CO32-+Ba2+=BaCO3↓,结合反应的离子方程式计算该题.
解答 解:n(Na2CO3)=0.2mol/L×2L=0.4mol,n(Ba(OH)2)=0.1mol/L×1L=0.1mol,
二者发生CO32-+Ba2+=BaCO3↓,可知(Na2CO3过量,Ba2+完全反应,
0.1mol 0.1mol 0.1mol
(1)反应后剩余n(CO32-)=0.4mol-0.1mol=0.3mol,c(CO32-)=$\frac{0.3mol}{4L}$=0.075mol/L,
n(OH-)=0.1mol×2=0.2mol,c(OH-)=$\frac{0.2mol}{4L}$=0.05mol/L,
答:溶液M中c(CO32-)和c(OH-)分别是0.075mol/L、0.05mol/L;
(2)n(BaCO3)=0.1mol,m(BaCO3)=0.1mol×197g/mol=19.7g,
答:沉淀N的质量是19.7g.
点评 本题考查化学方程式的计算,为高频考点,题目难度中等,明确发生反应实质为解答关键,注意掌握物质的量浓度的计算方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
2.将5mL 0.4molL -1AgNO3溶液与10mL 0.3molL -1BaCl2溶液混合,反应后溶液中离子浓度最大的是( )
| A. | Ag + | B. | NO ${\;}_{3}^{-}$ | C. | Cl- | D. | Ba2+ |
3.下列对实验过程的评价正确的是( )
| A. | 某固体加入稀盐酸,产生了无色气体,证明该固体一定是碳酸盐 | |
| B. | 某溶液中滴加BaCl2溶液,生成不溶于稀HNO3的白色沉淀,该溶液中一定含SO42- | |
| C. | 某无色溶液中滴入无色酚酞显红色,该溶液一定显碱性 | |
| D. | 验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含Cl- |
17.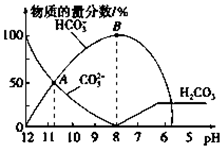 常温下,在10mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
 常温下,在10mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )| A. | 在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-) | |
| B. | 当溶液的pH为7时,溶液的总体积大于20mL | |
| C. | 在B点所示的溶液中,浓度最大的离子是HCO3- | |
| D. | 在0.1 mol•L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
1.Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”. S2O32-和Cl2反应的产物之一为SO42-.下列说法中,不正确的是( )
| A. | 上述反应中,每生成1mol SO42-,可脱去2mol Cl2 | |
| B. | 该反应中氧化剂是Cl2,反应消耗的氧化剂与还原剂之比为4:1 | |
| C. | 根据该反应可判断还原性:S2O32->Cl- | |
| D. | SO2也有漂白性,将SO2与氯气混合后使用,漂白性会增强 |
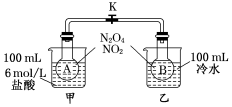 为测定温度对平衡的影响,设计了如下试验.
为测定温度对平衡的影响,设计了如下试验.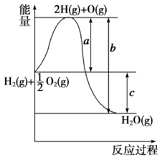 已知H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,则:
已知H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,则: