题目内容
15.下列物质中只含离子键的化合物是( )| A. | NaCl | B. | Fe | C. | HCl | D. | N2 |
分析 一般来说,活泼金属元素和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,铵根离子和酸根离子之间存在离子键,据此分析解答.
解答 解:A.NaCl属于离子晶体,阴阳离子之间存在离子键,故A正确;
B.Fe是金属单质属于金属晶体,只存在金属键,故B错误;
C.HCl属于分子晶体,HCl分子中H-Cl原子之间只存在共价键,故C错误;
D.N2属于分子晶体,分子中N与N原子之间只存在共价键,故D错误.
故选A.
点评 本题考查离子键、共价键,侧重考查基本概念,题目难度不大,明确晶体类型、晶体构成微粒及微粒之间作用力即可解答,注意Fe是金属单质属于金属晶体.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列化学用语书写正确的是( )
| A. | 甲烷的电子式: | B. | 丙烯的键线式: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 苯的化学式:C8H8 |
3.下列对实验过程的评价正确的是( )
| A. | 某固体加入稀盐酸,产生了无色气体,证明该固体一定是碳酸盐 | |
| B. | 某溶液中滴加BaCl2溶液,生成不溶于稀HNO3的白色沉淀,该溶液中一定含SO42- | |
| C. | 某无色溶液中滴入无色酚酞显红色,该溶液一定显碱性 | |
| D. | 验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含Cl- |
5.可用分液漏斗分离的一组混合物是( )
| A. | 硝基苯和酒精 | B. | 溴苯和溴 | C. | 甲苯和苯 | D. | 硝基苯和水 |
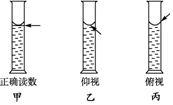 在配制一定物质的量浓度溶液的实验中,用量筒去取用一定量的浓溶液.量液时,量筒必须放平,视线要跟量筒内液体的凹液面最低点保持水平(如图甲),再读出液体的体积数.
在配制一定物质的量浓度溶液的实验中,用量筒去取用一定量的浓溶液.量液时,量筒必须放平,视线要跟量筒内液体的凹液面最低点保持水平(如图甲),再读出液体的体积数.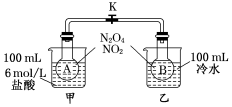 为测定温度对平衡的影响,设计了如下试验.
为测定温度对平衡的影响,设计了如下试验.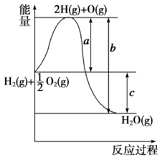 已知H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,则:
已知H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,则: