题目内容
3.设NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 0.5mol/L亚硫酸钠溶液中含有的SO32-的物质的量为0.5mol | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 过量铜片与100mL18mol/L的浓硫酸反应,转移的电子数为1.8NA |
分析 A、D2O的摩尔质量为20g/mol,而D2O和H2O中均含10个质子;
B、溶液体积不明确;
C、过氧化钠与水反应时,氧元素的价态由-1价变为0价;
D、铜只能和浓硫酸反应,和稀硫酸不反应,故浓硫酸不能反应完全.
解答 解:A、D2O的摩尔质量为20g/mol,故18g重水的物质的量为0.9mol,18g水的物质的量为1mol,而D2O和H2O中均含10个质子,故0.9mol重水中的质子数为9NA个,故A错误;
B、溶液体积不明确,故溶液中的亚硫酸根个数无法计算,故B错误;
C、过氧化钠与水反应时,氧元素的价态由-1价变为0价,故当生成0.1mol氧气时,转移电子0.2NA个,故C正确;
D、铜只能和浓硫酸反应,和稀硫酸不反应,故浓硫酸不能反应完全,故转移的电子小于1.8NA个,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
13.下列物质的转化在给定条件下能实现的是( )
| A. | NaCl(aq)$\stackrel{CO_{2}}{→}$NaHCO3(s) $\stackrel{△}{→}$Na2CO3(s) | |
| B. | CuCl2$\stackrel{NaOH(aq)}{→}$ Cu(OH)2 $→_{△}^{葡萄糖}$Cu | |
| C. | Al $\stackrel{NaOH(aq)}{→}$ NaAlO2(aq) $\stackrel{△}{→}$ NaAlO2(s) | |
| D. | MgO(s)$\stackrel{HNO_{3}(aq)}{→}$ Mg(NO3)2(aq) $\stackrel{电解}{→}$ Mg(s) |
14.已知在25℃,101kPa下,57gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出2758.80kJ热量.表示上述反应的热化学方程式正确的是( )
| A. | C8H18(l)+12.5O2(g)=8CO2(g)+9H2O(g)△H=-48.40kJ•mol-1 | |
| B. | C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1)△H=-5517.6kJ•mol-1 | |
| C. | C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1)△H=+5517.6kJ•mol-1 | |
| D. | C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1)△H=-48.40kJ•mol-1 |
11.下列能说明氯元素的非金属性比硫元素强的事实是( )
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
| A. | ①②④⑤ | B. | ①②③⑥ | C. | ①③⑤⑥ | D. | ①③④⑥ |
18.下表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
(1)元素⑥的名称为氮;⑨的最高价含氧酸的化学式为HBrO4.
(2)①和⑦两种元素的原子按1:1组成的常见化合物的结构式为H-O-O-H.
(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为Cl-、O2-、Mg2+、Al3+.(用离子符号表示)
(4)②、④的最高价氧化物的水化物之间发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(5)用电子式表示③和⑨组成的化合物的形成过程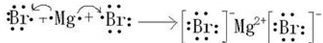 .
.
(6)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质.写出该反应的离子方程式2H++H2O2+2I-=2H2O+I2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ① | |||||||
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑨ | |||||||
| 5 | ⑩ |
(2)①和⑦两种元素的原子按1:1组成的常见化合物的结构式为H-O-O-H.
(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为Cl-、O2-、Mg2+、Al3+.(用离子符号表示)
(4)②、④的最高价氧化物的水化物之间发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(5)用电子式表示③和⑨组成的化合物的形成过程
 .
.(6)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质.写出该反应的离子方程式2H++H2O2+2I-=2H2O+I2.
15.同温同压下,KMnO4、KClO3、H2O2分解产生相同体积的氧气,三个反应中转移的电子数之比为( )
| A. | 1:1:l | B. | 1:1:2 | C. | 2:2:1 | D. | 4:3:2 |