题目内容
15.FeS溶于盐酸,CuS不溶于盐酸而溶于硝酸,主要是因为( )| A. | 水解能力不同 | B. | Ksp不同 | C. | 溶解的速度不同 | D. | 酸碱性不同 |
分析 CuS溶度积较小,不溶于盐酸,可与硝酸发生氧化还原反应而溶解,以此解答该题.
解答 解:FeS溶于盐酸,CuS不溶于盐酸,与溶度积大小有关,FeS的溶度积大,FeS能溶于盐酸(S2-与H+结合成H2S而逸出),而CuS的溶度积较小,不溶于盐酸,CuS溶于硝酸,是因为硝酸是强氧化性酸.可以将S离子氧化.与水解以及酸碱性不同.
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,侧重考查学生的分析能力,注意把握物质的性质,难度不大.

练习册系列答案
相关题目
5.要配制物质的量浓度约为2mol/L NaOH溶液100mL,下面的操作中,正确的是( )
| A. | 称取8 g NaOH固体,放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 | |
| B. | 称取8 g NaOH固体,放入100 mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL | |
| C. | 称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 | |
| D. | 用100 mL量筒量取40 mL 5 mol/L NaOH溶液,倒入250 mL烧杯中,再用同一量筒量取60 mL蒸馏水,不断搅拌下,慢慢倒入烧杯中 |
3.有A、B、C三种主族元素,已知A元素原子的价电子构型为nsn,B元素原子的M层上有两个未成对电子,C元素原子L层的p轨道上有一对成对电子,由这三种元素组成的化合物的化学式不可能是( )
| A. | A3BC4 | B. | A2BC4 | C. | A2BC3 | D. | A4BC4 |
20.鉴别下列各组有机物,所选用的试剂不正确的是( )
| A. | 鉴别苯与四氯化碳:碘水 | |
| B. | 鉴别甲烷与乙烯:酸性高锰酸钾溶液 | |
| C. | 鉴别 与CH≡CH:溴水 与CH≡CH:溴水 | |
| D. | 鉴别NaCl与CH3CH2Cl:硝酸银溶液 |
4. 常温下,在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
 常温下,在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )| A. | 在0.1 mol•L-1Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 当溶液的pH为7时,溶液的总体积为20 mL | |
| C. | 在B点所示的溶液中,离子浓度最大的是HCO3- | |
| D. | 在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
5.下列叙述中,错误的是( )
| A. | 新制氯水的氧化性强于久置氯水 | |
| B. | 过量铁与Cl2反应时生成FeCl2 | |
| C. | 1molCl2与热NaOH溶液反应生成NaClO3和NaCl时,需NaOH 2mol | |
| D. | 将饱和氯水滴到淀粉碘化钾试纸上,试纸先变蓝后变白,说明氯水具有强氧化性 |


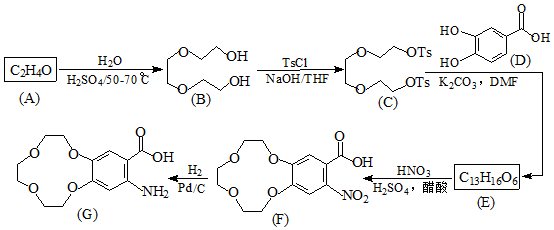
 .
. .
. .
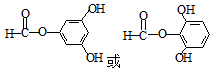
.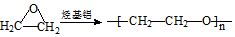 .
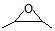
. .
. )和邻二苯酚为原料(其它试剂任选),设计制备
)和邻二苯酚为原料(其它试剂任选),设计制备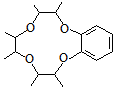 的合成路线.
的合成路线.