题目内容
3.有A、B、C三种主族元素,已知A元素原子的价电子构型为nsn,B元素原子的M层上有两个未成对电子,C元素原子L层的p轨道上有一对成对电子,由这三种元素组成的化合物的化学式不可能是( )| A. | A3BC4 | B. | A2BC4 | C. | A2BC3 | D. | A4BC4 |
分析 有A、B、C三种主族元素,已知A元素原子的价电子构型为nsn,n为1时,A为H,n=2时A可能Be;B元素原子的M层上有两个未成对电子,价电子为3s23p2或3s23p4,B为Si或S;C元素原子L层的p轨道上有一对成对电子,价电子为2s22p4,C为O元素,以此来解答.
解答 解:由上述分析可知,A为H或Be,B为Si或S,C为O,
由元素的化合价及化合物中正负化合价的代数和为0可知,存在H2SiO3、H2SO3、H4SiO4、H2SO4,不存在A3BC4,
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、电子排布规律来推断元素为解答的关键,侧重分析与应用能力的考查,注意元素的化合价,题目难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
4.短周期主族元素甲、乙、丙、丁的原子序数依次增大,甲的L层电子数是K层的3倍,丁所在族序数是周期数的2倍,乙、丙、丁的最外层电子数之和为10.下列说法正确的是( )
| A. | 最高价氧化物对应水化物的碱性:乙>丙 | |
| B. | 简单气态氢化物的稳定性:丁>甲 | |
| C. | 简单离子半径:乙>丙>丁 | |
| D. | 甲和乙组成的化合物只存在离子键 |
14.下列各组元素中,原子半径依次增大的是 ( )
| A. | O、Na、S | B. | I、Br、Cl | C. | Al、Si、P | D. | Li、Na、K |
11.化学与生产、生活、环境密切相关,下列有关叙述正确的是( )
| A. | 汽车尾气中含有的氮氧化物是汽油不完全燃烧造成的 | |
| B. | 光导纤维、碳纤维、聚酯纤维都是新型无机非金属材料 | |
| C. | PM2.5(颗粒直径接近2.5×10-6m)分散在空气中能够产生丁达尔效应 | |
| D. | 以液化石油气代替燃油可减少大气污染 |
18.下列物质性质的递变关系正确的有( )
①稳定性:HCl>H2S>PH3
②离子半径:O2->F->Na+>Mg2+>Al3+
③碱性:NaOH>KOH>Ca(OH)2>Mg(OH)2
④最高化合价:Cl>Si>Al>F
⑤沸点:HF>HCl>HBr>HI.
①稳定性:HCl>H2S>PH3
②离子半径:O2->F->Na+>Mg2+>Al3+
③碱性:NaOH>KOH>Ca(OH)2>Mg(OH)2
④最高化合价:Cl>Si>Al>F
⑤沸点:HF>HCl>HBr>HI.
| A. | ①②④⑤ | B. | ①②④ | C. | ①②⑤ | D. | ①④⑤ |
15.FeS溶于盐酸,CuS不溶于盐酸而溶于硝酸,主要是因为( )
| A. | 水解能力不同 | B. | Ksp不同 | C. | 溶解的速度不同 | D. | 酸碱性不同 |
12.短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y的原子序数之和等于Z的原子序数;Y、Z为同周期相邻元素,X、W、Y分别排列在三个连续的奇数族.下列说法正确的是( )
| A. | 简单离子半径:W>Y>Z | |
| B. | 最高价氧化物对应水化物的酸性:Y<Z | |
| C. | 工业上制备W单质的方法为热还原法 | |
| D. | X分别与Y、Z形成的简单化合物所含化学键类型相同 |
13.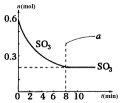 在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2(g)+O2(g)-Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是( )
在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2(g)+O2(g)-Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是( )
 在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2(g)+O2(g)-Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是( )
在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2(g)+O2(g)-Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是( )| A. | 0~8min内v(SO3)=0.025mol/(L•min) | |
| B. | 8min时,v逆(SO2)=2v正 (O2) | |
| C. | 8min时,容器内压强保持不变 | |
| D. | 若8min时将容器压缩为1L,n(SO3)的变化如图中a |
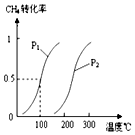 在容积为100L的密闭容器中,加入1.0molCH4和2.0molH2O(g).一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)△H
在容积为100L的密闭容器中,加入1.0molCH4和2.0molH2O(g).一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)△H