题目内容
18.化学上为了方便,常将电离平衡常数的负对数称为pKa,即pKa=-lgKa,亚硫酸和碳酸的pKa数据如下:| 物质 | H2SO3 | HSO3- | H2CO3 | HCO3- |
| PKa | 1.9 | 7.2 | 6.4 | 10.3 |
(2)向10mL 0.01mol/L的H2SO3溶液中,滴加0.0lmol/L KOH溶液V(mL).
①当V=10mL时,溶液中存在:c(K+)>c(HSO3-)>c(SO32-)>c(H2SO3),则c(H+)>c(OH-)(选填“<”、“>”、“=”).
②当V=a mL时,溶液中离子浓度有如下关系:c(K+)=2c(SO32-)+c(HSO3-),该溶液呈中性(选填“酸”、“中”、“碱”).当V=b mL时,溶液中离子浓度有如下关系:c(K+)=c(SO32-)+c(HSO3--)+c(H2SO3),该溶液呈酸性(选填“酸”、“中”、“碱”),则a>b(选填“<”、“>”、“=”).
分析 (1)根据pKa越小,电离平衡常数Ka越大,则对应酸的酸性就强,利用酸越弱则强碱弱酸盐的水解程度越大来分析;
(2)①V=10mL,溶液中的溶质为NaHSO3,由c(HSO3-)>c(SO32-)>c(H2SO3),可知HSO3-的电离大于其水解来分析;
②V=a mL时由c(K+)=2c(SO32-)+c(HSO3-),则c(H+)=c(OH-);V=b mL时,c(K+)=c(SO32-)+c(HSO3-)+c(H2SO3),即溶液中的溶质为KHSO3,溶液显酸性.
解答 解:(1)由pKa数据可知,亚硫酸的pKa小于碳酸,则酸性比碳酸的强,相同浓度的NaHSO3溶液比NaHCO3溶液中酸根离子的水解程度弱,则NaHSO3溶液的pH小,即bl<b2,故答案为:<;
(2)①V=10mL,溶液中的溶质为NaHSO3,由c(HSO3-)>c(SO32-)>c(H2SO3),可知HSO3-的电离大于其水解,电离生成氢离子,水解生成氢氧根离子,即c(H+)>c(OH-),
故答案为:>;
②V=a mL时,由c(K+)=2c(SO32-)+c(HSO3-),由电荷守恒可知,则c(H+)=c(OH-),所以溶液显中性;V=b mL时,c(K+)=c(SO32-)+c(HSO3-)+c(H2SO3),即溶液中的溶质为KHSO3,溶液显酸性,则向10mL0.01mol•L-1的H2SO3溶液中,滴加0.0l mol•L-1KOH溶液,由酸性变为中性时碱的体积在变大,即a>b,
故答案为:中;酸;>.
点评 本题考查溶液中的电离及离子的浓度关系,题目难度中等,学生应学会利用信息中的数据来分析是解答本题的关键,然后注重结合电荷守恒等知识来解答即可.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
6.物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当它们的体积比为1:2:3时,三种溶液中Cl-的物质的量之比为( )
| A. | 3:4:3 | B. | 1:2:3 | C. | 3:2:1 | D. | 1:4:9 |
13.有人曾建议用 AG 表示溶液的酸度,AG 的定义为:AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$,室温下实验室用0.01mol?L-1 的氢氧化钠溶液滴定 20mL 相同浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )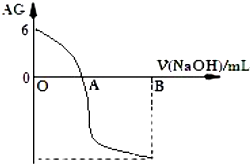

| A. | A 点时加入氢氧化钠溶液体积为 20 mL | |
| B. | OA 段溶液中:c(CH3COO-)>c(CH3COOH) | |
| C. | 室温时 0.01 mol/L的醋酸溶液 pH=4 | |
| D. | 若 B 点时加入 NaOH 溶液为 40 mL,所得溶液中:c(CH3COO-)+c(CH3COOH)=c(OH-) |
10.下列说法正确的是( )
| A. | 将0.2 mol/L的一元酸HA溶液和0.1 mol/L的NaOH溶液混合,混合液中一定有:c(OH-)+c(A-)=c(H+)+c(Na+) | |
| B. | 某溶液中由水电离出的c(OH-)=1×10-9mol/L,则该溶液的pH一定为5 | |
| C. | 室温下,NaHSO3溶液的pH<7,则溶液中c(SO32-)<c(H2SO3) | |
| D. | Na2CO3溶液与NaHCO3溶液混合一定有2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] |
7.单斜硫和正交硫是硫的两种同素异形体
已知:①S(单斜,s)+O2(g)═SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)═SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)═S(正交,s)△H3
下列说法正确的是( )
已知:①S(单斜,s)+O2(g)═SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)═SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)═S(正交,s)△H3
下列说法正确的是( )
| A. | △H3=+0.33 kJ•mol-1 | |
| B. | 单斜硫转化为正交硫的反应是吸热反应 | |
| C. | △H3<0,正交硫比单斜硫稳定 | |
| D. | △H3>0,单斜硫比正交硫稳定 |
 (注:R、R′为径基).A为有机合成中间体,可发生银镜反应.A在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化.
(注:R、R′为径基).A为有机合成中间体,可发生银镜反应.A在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化.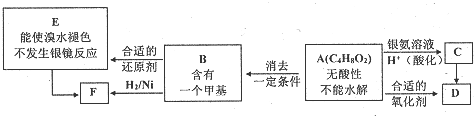
 或
或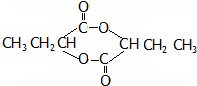 .
. .
.